题目内容
9.与500mL1mol/LNaNO3中的NO3-浓度相等的是( )| A. | 100mL 2mol/L NH4NO3溶液 | B. | 40mL 0.5mol/L Ca(NO3)2溶液 | ||
| C. | 50mL 1.5mol/L Al(NO3)3溶液 | D. | 150mL 1mol/L Mg(NO3)2溶液 |
分析 根据溶液中不水解的离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数进行计算硝酸根离子的物质的量浓度,与溶液的体积无关,500mL1mol/LNaNO3中NO3- 物质的量浓度=1mol/L×1=1mol/L.
解答 解:A、100mL 2mol/L NH4NO3溶液中NO3- 物质的量浓度=2mol/L×1=2mol/L.
B、40mL 0.5mol/L Ca(NO3)2溶液中NO3- 物质的量浓度=0.5mol/L×2=1mol/L.
C、50mL 1.5mol/L Al(NO3)3溶液中NO3- 物质的量浓度=1.5mol/L×3=4.5mol/L.
D、150mL 1mol/L Mg(NO3)2溶液中NO3- 物质的量浓度=1mol/L×2=2mol/L.
故选B.
点评 本题考查了离子浓度和溶质浓度的关系分析,明确“溶液中不水解的离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数进行计算硝酸根离子的物质的量浓度,难度不大.

练习册系列答案
相关题目
19.“类推”是一种常用的学习方法,但有时会产生错误的结论,下列类推结论中正确的是( )
| A. | IVA族元素氢化物熔点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物熔点顺序也是:AsH3>PH3>NH3 | |
| B. | 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| C. | 工业上用电解氯化镁制备镁单质,工业上也可用电解氯化铝制备铝单质 | |
| D. | Fe3O4可改写成氧化物的形式为:FeO•Fe2O3;因此Pb3O4也可改写为:PbO•Pb2O3 |
20.目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金.该电池在充电过程中的总反应方程式是:Ni(OH)2+M=NiOOH+MH,已知:6NiOOH+NH3+H2O+OH-=6Ni(OH)2+NO2-,下列说法正确的是( )
| A. | NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 充电过程中OH-离子从阳极向阴极迁移 | |
| C. | 充电过程中阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原 | |
| D. | NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
17.下列化学实验事实及其解释都正确的是( )
| A. | 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 | |
| B. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| C. | 石墨转化为金刚石的反应是吸热反应,说明等量的石墨比金刚石能量高 | |
| D. | 某溶液用盐酸酸化无明显现象,再滴加氯化钡溶液有白色沉淀产生,说明溶液中有SO42- |
4.含有离子键的物质是( )
| A. | Cl2 | B. | H2O | C. | CO2 | D. | NaCl |
1.下列有关化学用语表示正确的是( )
| A. | Mg2+结构示意图: | B. | CCl4分子的比例模型: | ||
| C. | NH4Cl的电子式: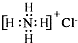 | D. | 2-甲基丁醇的结构简式: |
18.分别在250℃和T℃下将1mol CO和2molH2充入一容积为1L的密闭容器中发生反应:CO(g)+2H2(g)?CH2OH(g)△H=a kJ/mol,结合如图分析下列说法中正确的是( )

| A. | 混合气体的密度不变能说明该反应到达平衡状态 | |
| B. | a>0 | |
| C. | 其他条件不变,若减小容积体积,CO质量分数增大 | |
| D. | 平衡常数K:T℃时大于250℃ |
19.下列离子方程式书写不正确的是( )
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 氨水吸收足量的SO2气体:NH3•H2O+SO2═NH4++HSO3- | |
| C. | 少量SO2通入NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ | |
| D. | 向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |