题目内容
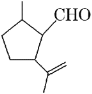
【题目】A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1)写出C元素基态原子的电子排布式: ________________ 。
(2)用电子排布图表示D元素原子的价电子:__________。
(3)元素B与D的电负性的大小关系是B___ D (填“>”“<”或“=”,下同), E与C的第一电离能大小关系是E____C。
(4)写出元素E和C的最高价氧化物对应的水化物之间反应的离子方程式__________。
【答案】1s22s22p63s23p1 ![]() > <
> < ![]()
【解析】
A、E同族,且最外层电子排布为ns1。是IA族,E是金属元素,5种元素核电荷数依次增大,可以推知A为H元素;B、D同族,且最外层p能级电子数是s能级电子数的两倍,是第六主族元素,所以B是氧元素,D是硫元素,E是钾元素,根据C原子最外层上电子数等于D原子最外层上电子数的一半可以推知C是铝元素,总结A为氢元素、B为氧元素、C为铝元素、D为硫元素、E为钾元素,据此分析问题。
(1)C元素为Al,原子序数13,基态原子的电子排布式: 1s22s22p63s23p1;
答案:1s22s22p63s23p1
(2)D元素为S,原子序数16,最外层有6个电子,用电子排布图表示S元素原子的价电子: ![]() ;
;
答案:![]()
(3)同一主族从上到下非金属性减弱,电负性减小,元素O与S的电负性的大小关系是O>S,金属性越强,第一电离能越小, K与Al的第一电离能大小关系是K<Al;
答案:> <
(4)氢氧化铝具有两性,可以与强碱反应生成偏铝酸盐和水,离子方程式为Al(OH)3+OH-==AlO2-+2H2O;
答案: Al(OH)3+OH-=AlO2-+2H2O

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】截止2020年4月5日,全球新型冠状病毒肺炎确诊超过120万例。以下对预防新冠病毒的认识,不符合科学道理的是( )
A | B | C | D |
|
|
|
|
84消毒液使用时不能和洁厕灵混用 | 医用酒精消毒效果浓度95%>75% | 口罩关键一层聚丙烯熔喷布属于有机高分子材料 | 温度计中水银属于金属单质 |
A.AB.BC.CD.D