题目内容
【题目】下表是元素周期表的一部分,回答下列有关问题:

(1)写出⑥的元素符号: ____________,画出![]() 的原子结构示意图________________;
的原子结构示意图________________;
(2)写出③的单质在空气中燃烧后的产物与二氧化碳反应的化学方程式:___________________________________;该反应每生成1mol气体转移_______个电子。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是___________________,碱性最强的是___________________,呈两性的氢氧化物是___________________;
(4)写出单质③在空气中燃烧生成产物的电子式___________________;
(5)用电子式表示出④的氯化物的形成过程_____________________________________;
(6)写出实验室制取⑧的单质的化学方程式 ___________________________________。
【答案】Si ![]() 2Na2O2+2CO2=2Na2CO3+O2 1.204×1024 HClO4 KOH Al(OH)3
2Na2O2+2CO2=2Na2CO3+O2 1.204×1024 HClO4 KOH Al(OH)3 ![]()
![]() MnO2+4HCl(浓)
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
【解析】
由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦S、⑧为Cl、⑨为Ar、⑩为K、![]() 为Ca、
为Ca、![]() 为Br。
为Br。
(1)⑥的元素符号:Si,![]() 为Br,原子序号35,溴的原子结构示意图
为Br,原子序号35,溴的原子结构示意图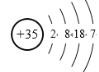 ;故答案为:Si;
;故答案为:Si; ;
;
(2)③为钠,钠单质在空气中燃烧后的产物是过氧化钠,过氧化钠与二氧化碳反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2;该反应每生成1mol气体转移1.204×1024个电子。故答案为:2Na2O2+2CO2=2Na2CO3+O2;1.204×1024;
(3)非金属性越强,最高价含氧酸的酸性越强,F元素没有最高价含氧酸,故HClO4的酸性最强;金属性越强,最高价氧化物对应水化物的碱性越强,故KOH的碱性最强;Al(OH)3是两性氢氧化物;故答案为:HClO4;KOH;Al(OH)3;
(4)过氧化钠为离子化合物,化合物中存在钠离子和过氧根离子,过氧化钠的电子式为:![]() ;故答案为:
;故答案为:![]() ;
;
(5)MgCl2为离子化合物,阴离子需要标出最外层电子,用电子式表示氯化镁的形成过程为:![]() ;故答案为:
;故答案为:![]() ;
;
(6)实验室用二氧化锰和浓盐酸制取氯气的单质的化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案