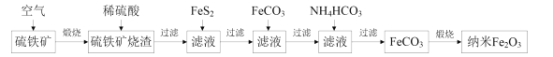
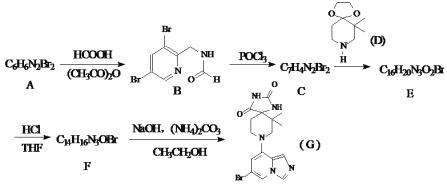
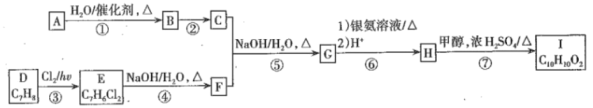
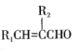
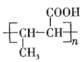
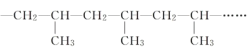
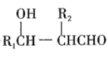题目内容
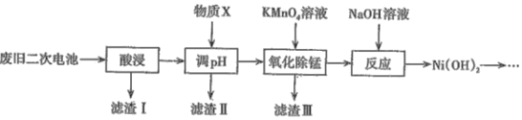
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出重要贡献的科学家。利用废旧二次电池[主要成分为Ni(OH)2、Fe2O3、MnO2、碳粉、铝箔等]合成电池级Ni(OH)2的工艺流程如下:
已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Mn(OH)2 |
Ksp(室温下) | 4.0×10-38 | 1.0×10-33 | 1.6×10-14 | 2.0×10-13 |
(1)①已知“酸浸”后滤液中含有:Ni2+、Al3+、Fe3+、Mn2+,调节溶液的pH约为5,其目的是__;以下最适合作为物质X的是____(填字母)。
A.双氧水 B.氨水 C.盐酸 D.NiO
②若滤液中Ni2+的浓度为2molL-1,列式计算判断此时滤渣Ⅱ中是否有Ni(OH)2沉淀:___ 。
(2)滤渣Ⅲ的主要成分是____,“氧化除锰”过程发生反应的离子方程式为______。
(3)用Ni(OH)2和LiOH在空气中混合加热至700℃~800℃可制得LiNiO2(镍酸锂),该反应的化学方程式为___________。
(4)镍酸锂是一种有较好前景的锂离子电池正极材料。该电池在充放电过程中,发生LiNiO2和Li1-xNiO2之间的转化,充电时LiNiO2在_______(填“阴”或“阳“)极发生反应,该电极的电极反应式为_____。
【答案】除去Al3+、Fe3+ D pH=5时,滤液中c(OH-)=1×10-9mol/L,Qc=c(Ni2+)c2(OH-)=2×10-18< Ksp[Ni(OH)2],故没有沉淀产生 MnO2 2MnO4-+3Mn2++2H2O==5MnO2↓+4H+ 4Ni(OH)2+4LiOH+O2![]() 4LiNiO2+6H2O 阳 LiNiO2-xe- =Li1-xNiO2+xLi+
4LiNiO2+6H2O 阳 LiNiO2-xe- =Li1-xNiO2+xLi+
【解析】
废旧二次电池[主要成分为Ni(OH)2、Fe2O3、MnO2、碳粉、铝箔等]酸浸后,所得的滤液中含有Ni2+、Al3+、Fe3+、Mn2+,此时碳粉不溶而成为滤渣Ⅰ;调节溶液的pH约为5,由后续操作可以看出,此时Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀,可利用Ksp通过计算加以证实,所以加入的物质X用于调节溶液的pH;加入KMnO4氧化除锰(Mn2+)时,产物中Mn的价态应介于+2~+7之间,考虑到此时Mn转化为难溶物,应为MnO2,此为滤渣Ⅲ的主要成分;溶液中的Ni2+加入NaOH溶液后,转化为Ni(OH)2沉淀。
(1)①由以上分析知,调节溶液的pH约为5,其目的是除去Al3+、Fe3+;双氧水难以调节pH至5,氨水可调节溶液的pH为5,但引入NH4+,加入盐酸不能增大溶液的pH,所以选择NiO,故选D。答案为:除去Al3+、Fe3+;D;
②若滤液中Ni2+的浓度为2molL-1,列式计算判断此时滤渣Ⅱ中是否有Ni(OH)2沉淀: pH=5时,滤液中c(OH-)=1×10-9mol/L,Qc=c(Ni2+)c2(OH-)=2×10-18< Ksp[Ni(OH)2],故没有沉淀产生。答案为:pH=5时,滤液中c(OH-)=1×10-9mol/L,Qc=c(Ni2+)c2(OH-)=2×10-18< Ksp[Ni(OH)2],故没有沉淀产生;
(2)由以上分析知,滤渣Ⅲ的主要成分是MnO2,“氧化除锰”过程发生反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+。答案为:MnO2;2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
(3)用Ni(OH)2和LiOH在空气中混合加热至700℃~800℃可制得LiNiO2,Ni由+2价升高到+3价,则反应物中应有氧化剂(O2)参加反应,该反应的化学方程式为4Ni(OH)2+4LiOH+O2![]() 4LiNiO2+6H2O。答案为:4Ni(OH)2+4LiOH+O2
4LiNiO2+6H2O。答案为:4Ni(OH)2+4LiOH+O2![]() 4LiNiO2+6H2O;
4LiNiO2+6H2O;
(4)充电时LiNiO2转化为Li1-xNiO2,Ni价态由+3价升高为+(3+x)价,所以在阳极发生反应,该电极的电极反应式为LiNiO2-xe- =Li1-xNiO2+xLi+。答案为:阳;LiNiO2-xe- =Li1-xNiO2+xLi+。

【题目】碳及其化合物在化工生产中有着广泛的应用。
I.为解决大气中CO2的含量增大的问题,某科学家提出如下构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,在合成塔中经化学反应使废气中的CO2转变为燃料甲醇。部分技术流程如下:
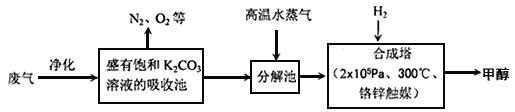
⑴合成塔中反应的化学方程式为_________;△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了_____。
(2)从合成塔分离出甲醇的原理与下列_______操作的原理比较相符(填字母)
A.过滤 B.分液 C.蒸馏 D.结晶
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。写出CO2(g)与H2(g)反应生CH4(g)与液态水的热化学方程式_____。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
II.某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(1)从反应开始到20min时,以CO表示反应速率为________。
(2)下列描述能说明反应达到平衡的是_______
A.装置内气体颜色不再改变 B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变 D.容器内气体密度保持不变
(3)该温度下平衡常数K=_______,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将_________ (填“增大”、“减小”或“不变”)
(4)该反应达到平衡后,再向容器中充入1mol CO和2mol H2,此时CO的转化率将_____(填“增大”、“减小”或“不变”)
Ⅲ. 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
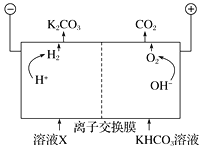
①在阳极区发生的反应包括_________和H++HCO![]() ===H2O+CO2↑。
===H2O+CO2↑。
②简述CO32-在阴极区再生的原理:______。