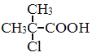题目内容
【题目】以原油为原料生产聚烯烃的几个步骤如下:
![]()
(1)步骤①使用的方法是分馏,分馏是利用原油中各组分的______不同进行分离的过程。
(2)步骤①所得C4~C10 的烃类混合物中所含的物质超过 7 种。请以C4H10 为例说明其原因______。
(3)步骤③中,聚烯烃的合成反应与聚乙烯的相同,该反应类型是_____。生产的聚丙烯可用下图表示,其重复结构单元是_________。
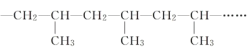
(4)乙烯是一种重要的基本化工原料,可制备乙酸乙酯,其转化关系如图。
已知:H2C==CHOH 不稳定
I.①的反应类型是______。
II.B的结构简式是_______。
III.④的化学方程式是_______。
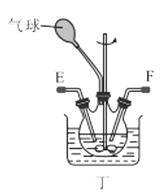
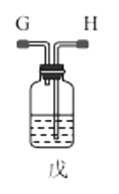
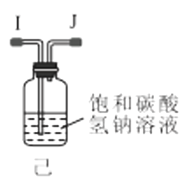
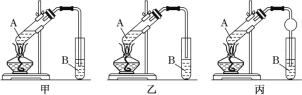
IV.实验室制取乙酸乙酯的装置如图所示。能完成本实验的装置是_____(填“甲”“乙”或“丙”),试管B 内盛放的液体是___________。
【答案】沸点 分子式为 C4H10 的烃有两种结构:CH3(CH2)2CH3 和 CH(CH3)3,所以 C4~C10的烃因存在同分异构现象,其所含烃的种类超过 7 种 加聚反应 ![]() 加成反应 CH3CHO CH3COOH+CH3CH2OH
加成反应 CH3CHO CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 乙、丙 饱和碳酸钠溶液
CH3COOCH2CH3+H2O 乙、丙 饱和碳酸钠溶液
【解析】
(1)利用石油中各成分的沸点不同,将它们分离出来的方法叫分馏,所以分馏是利用原油中各组分的沸点不同进行分离的过程;
(2)分子式为C4H10的烃有正丁烷和异丁烷两种结构,CH3(CH2)2CH3和CH(CH3)3,则C4~C10的烃由于存在同分异构现象,所以所含的烃的种类超过7种;
(3)步骤③中,聚烯烃的合成反应与生成聚乙烯的反应类型相同,都是加成聚合反应,简称加聚反应,![]() 中重复的结构单元为
中重复的结构单元为![]() ;
;
(4)乙烯通过反应①生成A,A被酸性高锰酸钾溶液氧化生成M,A与M发生酯化反应生成乙酸乙酯,则A为乙醇,M为乙酸,A通过反应②生成B,B通过反应③生成M,则B为CH3CHO;
Ⅰ.反应①为乙烯与水反应生成乙醇,该反应为加成反应;
Ⅱ.根据分析可知,B为乙醛,其结构简式为CH3CHO;
Ⅲ.反应④为乙醇与乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯和水,反应的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
IV.制取乙酸乙酯时,蒸汽中往往含有乙醇和乙酸,所以用饱和碳酸钠溶液吸收掉从而与乙酸乙酯分离,但是二者易溶于水而产生倒吸,乙导管没有插入到液面以下,丙导管上端容积较大,二者都可防止倒吸。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出重要贡献的科学家。利用废旧二次电池[主要成分为Ni(OH)2、Fe2O3、MnO2、碳粉、铝箔等]合成电池级Ni(OH)2的工艺流程如下:
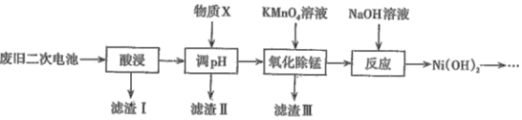
已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Mn(OH)2 |
Ksp(室温下) | 4.0×10-38 | 1.0×10-33 | 1.6×10-14 | 2.0×10-13 |
(1)①已知“酸浸”后滤液中含有:Ni2+、Al3+、Fe3+、Mn2+,调节溶液的pH约为5,其目的是__;以下最适合作为物质X的是____(填字母)。
A.双氧水 B.氨水 C.盐酸 D.NiO
②若滤液中Ni2+的浓度为2molL-1,列式计算判断此时滤渣Ⅱ中是否有Ni(OH)2沉淀:___ 。
(2)滤渣Ⅲ的主要成分是____,“氧化除锰”过程发生反应的离子方程式为______。
(3)用Ni(OH)2和LiOH在空气中混合加热至700℃~800℃可制得LiNiO2(镍酸锂),该反应的化学方程式为___________。
(4)镍酸锂是一种有较好前景的锂离子电池正极材料。该电池在充放电过程中,发生LiNiO2和Li1-xNiO2之间的转化,充电时LiNiO2在_______(填“阴”或“阳“)极发生反应,该电极的电极反应式为_____。