题目内容
【题目】某科研小组利用硫铁矿(主要成分是FeS2,含Fe2O3、SiO2、Al2O3等杂质)制备重要的化工原料纳米Fe2O3的工艺流程如图所示。
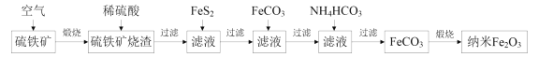
回答下列问题:
(1)煅烧前硫铁矿粉碎的目的是__,硫铁矿煅烧得到的气体需回收,该气体在工业上的主要用途是__。
(2)用稀硫酸浸取硫铁矿烧渣的主要反应的离子方程式为__,浸取后过滤得到的滤渣的化学式为__。
(3)加入FeS2的主要目的是还原滤液中的Fe3+,反应的化学方程式为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,反应中每消耗1molFeS2,转移的电子数目为__,检验Fe3+是否完全被还原,应选择__(填标号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(4)加FeCO3调溶液pH到5.8左右,其目的为__。
(5)加入NH4HCO3生成FeCO3的离子方程式为__,若煅烧得到160g纳米Fe2O3,则消耗的气体和生成的气体的物质的量之比为__。
【答案】增大接触面积,加快反应速率,使硫铁矿煅烧更加充分 工业制硫酸 Fe2O3+6H+=2Fe3++3H2O SiO2 14NA或8.428×1024 C 除去滤液中的Al3+ 2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O 1:4
【解析】
硫铁矿煅烧,发生FeS2与O2反应生成Fe2O3和SO2,加硫酸,Al2O3、Fe2O3与硫酸反应,SiO2不与硫酸反应,根据流程目的是制备纳米Fe2O3,需要除去Al3+,因为Fe(OH)3的溶度积小于Al(OH)3的溶度积,因此先将Fe3+转化成Fe2+,加入FeS2的目的是将Fe3+转化成Fe2+,加入FeCO3调节pH,使Al3+以Al(OH)3形式除去,加入NH4HCO3,Fe2+与HCO3-反应生成FeCO3,煅烧FeCO3得到Fe2O3,逐步进行分析;
(1)煅烧前粉碎硫铁矿,增加硫铁矿与空气的接触面积,加快反应速率,使硫铁矿煅烧更加充分;FeS2与O2发生4FeS2+11O2=2Fe2O3+8SO2,利用SO2制备硫酸;
(2)硫铁矿煅烧后的烧渣为Fe2O3、Al2O3、SiO2,SiO2为酸性氧化物不与硫酸反应,Fe2O3与硫酸反应生成Fe2(SO4)3,Al2O3与硫酸反应生成Al2(SO4)3,烧渣中Fe2O3为主要物质,因此加入硫酸发生的主要反应是Fe2O3+6H+=2Fe3++3H2O;浸取后的滤渣为SiO2;
(3)根据反应方程式,FeS2中S由-1价转化成+6价,Fe2(SO4)3中Fe的化合价由+3价转化成+2价,因此消耗1molFeS2,转移电子物质的量为1mol×2×[6-(-1)]=14mol,即转移电子物质的量为14NA或8.428×1024;检验Fe3+是否完全被还原,则需要检验是否含有Fe3+,即用KSCN溶液检验,如果溶液不变红,则说明Fe3+完全反应,反之未完全反应,答案悬C;
(4)根据上述分析,加入FeCO3的目的是调节pH,使Al3+以Al(OH)3形式沉淀出来;
(5)加入NH4HCO3溶液得到FeCO3,即反应的离子方程式为2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O;煅烧FeCO3得到Fe2O3反应方程式为4FeCO3+O2![]() 2Fe2O3+4CO2,消耗O2和生成CO2的物质的量之比为1:4。
2Fe2O3+4CO2,消耗O2和生成CO2的物质的量之比为1:4。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出重要贡献的科学家。利用废旧二次电池[主要成分为Ni(OH)2、Fe2O3、MnO2、碳粉、铝箔等]合成电池级Ni(OH)2的工艺流程如下:
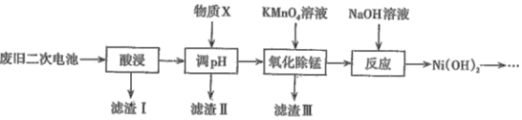
已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Mn(OH)2 |
Ksp(室温下) | 4.0×10-38 | 1.0×10-33 | 1.6×10-14 | 2.0×10-13 |
(1)①已知“酸浸”后滤液中含有:Ni2+、Al3+、Fe3+、Mn2+,调节溶液的pH约为5,其目的是__;以下最适合作为物质X的是____(填字母)。
A.双氧水 B.氨水 C.盐酸 D.NiO
②若滤液中Ni2+的浓度为2molL-1,列式计算判断此时滤渣Ⅱ中是否有Ni(OH)2沉淀:___ 。
(2)滤渣Ⅲ的主要成分是____,“氧化除锰”过程发生反应的离子方程式为______。
(3)用Ni(OH)2和LiOH在空气中混合加热至700℃~800℃可制得LiNiO2(镍酸锂),该反应的化学方程式为___________。
(4)镍酸锂是一种有较好前景的锂离子电池正极材料。该电池在充放电过程中,发生LiNiO2和Li1-xNiO2之间的转化,充电时LiNiO2在_______(填“阴”或“阳“)极发生反应,该电极的电极反应式为_____。