��Ŀ����
����Ŀ��̼���仯�����ڻ������������Ź㷺��Ӧ�á�
I��Ϊ���������CO2�ĺ�����������⣬ij��ѧ��������¹��룺�ѹ����ų��ĸ���CO2�ķ�������������̼�����Һ���գ�Ȼ���ٰ�CO2����Һ����ȡ�������ںϳ����о���ѧ��Ӧʹ�����е�CO2ת��Ϊȼ�ϼ״������ּ�����������:
�źϳ����з�Ӧ�Ļ�ѧ����ʽΪ_________����H<0���÷�ӦΪ���淴Ӧ����ƽ���ƶ�ԭ���������������������ԭ������ƽ��ת���ʡ���ʵ�������в���300����¶ȣ��������¶ȶԷ�Ӧ���ʵ�Ӱ���⣬����Ҫ������_____��
(2)�Ӻϳ���������״���ԭ��������_______������ԭ���Ƚ����(����ĸ��
A.���� B.��Һ C.���� D.�ᾧ
(3)�罫CO2��H2��1:4������Ȼ�ϣ����ʵ��������¿��Ƶ�CH4��д��CO2(g)��H2(g)��Ӧ��CH4(g)��Һ̬ˮ���Ȼ�ѧ����ʽ_____��
��֪��CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l) ��H2=-571.6kJ/mol
II��ij��ȤС��ģ�ҵ�ϳɼ״��ķ�Ӧ:CO(g)+2H2(g)![]() CH3OH(g)�����ݻ��̶�Ϊ2L���ܱ������г���1mol CO��2mol H2��������ʵĴ���������������Բ��ƣ���ʼ��Ӧ����������ڵ�ѹǿ��ʱ��仯����:
CH3OH(g)�����ݻ��̶�Ϊ2L���ܱ������г���1mol CO��2mol H2��������ʵĴ���������������Բ��ƣ���ʼ��Ӧ����������ڵ�ѹǿ��ʱ��仯����:
ʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 |
ѹǿ/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(1)�ӷ�Ӧ��ʼ��20minʱ����CO��ʾ��Ӧ����Ϊ________��
(2)����������˵����Ӧ�ﵽƽ�����_______
A.װ����������ɫ���ٸı� B.�����������ƽ��Ħ���������ֲ���
C.�����������ѹǿ���ֲ��� D.�����������ܶȱ��ֲ���
(3)���¶���ƽ�ⳣ��K=_______�����ﵽƽ����������CH3OH(g)����ʱƽ�ⳣ��Kֵ��_________ (����������������С������������)
(4)�÷�Ӧ�ﵽƽ������������г���1mol CO��2mol H2����ʱCO��ת���ʽ�_____(����������������С������������)
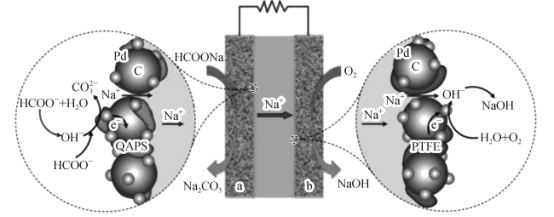
��. ����������CO2���ڻ��ۣ���в����̬����������������ܵ�ȫ�����ע����ҵ�ϳ��ø�Ũ�ȵ�K2CO3��Һ����CO2������ҺX�������õ�ⷨʹK2CO3��Һ��������װ��ʾ��ͼ���£�
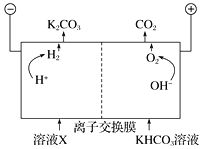
���������������ķ�Ӧ����_________��H����HCO![]() ===H2O��CO2����
===H2O��CO2����
�ڼ���CO32-��������������ԭ����______��
���𰸡�CO2+3H2![]() CH3OH+H2O �����Ĵ����� C CO2(g)+4H2(g) = CH4(g)+2H2O(l) ��H=-252.9kJ/mol 0.0125mol��L-1��min-1 BC 4 ���� ���� 4OH����4e��===2H2O��O2�� HCO3-���ڵ���ƽ�⣺HCO3-
CH3OH+H2O �����Ĵ����� C CO2(g)+4H2(g) = CH4(g)+2H2O(l) ��H=-252.9kJ/mol 0.0125mol��L-1��min-1 BC 4 ���� ���� 4OH����4e��===2H2O��O2�� HCO3-���ڵ���ƽ�⣺HCO3-![]() H����CO32-������H���ŵ�Ũ�ȼ�Сƽ�����ƣ�CO32-����
H����CO32-������H���ŵ�Ũ�ȼ�Сƽ�����ƣ�CO32-����
��������
I��(1)���ݹ������̿�֪���ϳ����ڷ�Ӧ�������������̼��Ӧ���ɼ״���ˮ����ҵ��������ѡ��Ҫ����ת���ʡ���Ӧ���ʡ��Դ�����Ӱ�졢���ϡ��ɱ��ȶ���ۺϿ��ǣ�
(2)�Ӻϳ�����������ҪΪ�״���ˮ�Ļ��Һ���״���ˮ���ܣ��е�����
(3)��֪����CH4(g)+2O2(g)=CO2(g)+2H2O(l)��H1=-890.3kJ/mol����2H2(g)+O2(g)�T2H2O(l)��H2=-571.6kJ/mol�����ݸ�˹������д�Ȼ�ѧ����ʽ��
II��(1)�ӷ�Ӧ��ʼ��20minʱ����CO��Ũ�ȱ仯����x��
CO(g)+2H2(g)CH3OH(g)
��ʼŨ��(mol/L)��0.5 1 �������� 0
�仯Ũ��(mol/L)��x 2x ������ x
ƽ��Ũ��(mol/L)��0.5-x 1-2x ���� x
���ݷ�Ӧǰ��ѹǿ֮�ȵ������ʵ���֮�ȣ���![]() =
=![]() �����x=0.25mol/L���ӷ�Ӧ��ʼ��20minʱ����CO��ʾ��ƽ����Ӧ����v=
�����x=0.25mol/L���ӷ�Ӧ��ʼ��20minʱ����CO��ʾ��ƽ����Ӧ����v=![]() ��
��
(2)��Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�ƽ��ʱ�������ʵ����ʵ�����Ũ�ȵȲ��ٷ����仯���Լ������������ı仯��������ɴ˽����жϣ�
(3)ƽ�ⳣ��������ƽ��״̬��������Ũ���ݴη��˻����Է�Ӧ��Ũ�ȵ��ݴη��˻��õ���ƽ�ⳣ�����¶ȱ仯��
(4)�÷�Ӧ�ﵽƽ������������г���1mol CO 2mol H2���൱������ƽ��ѹǿ��ƽ�������������С�ķ�����У�
III�������������������ӷŵ�����������
��̼��������Ӵ��ڵ���ƽ�⡢���������Ӻ�̼��������ӷ�Ӧ����̼������ӡ�
I��(1)�ϳ�����Ӧ�Ƕ�����̼��������һ�������¿����ɼ״���ˮ���䷽��ʽΪCO2+3H2![]() CH3OH+H2O���¶�Ӱ������Ļ��ԣ��������¶ȶԷ�Ӧ���ʵ�Ӱ���⣬����Ҫ���Ǵ����Ĵ����ԣ�
CH3OH+H2O���¶�Ӱ������Ļ��ԣ��������¶ȶԷ�Ӧ���ʵ�Ӱ���⣬����Ҫ���Ǵ����Ĵ����ԣ�
(2)�Ӻϳ�����������ҪΪ�״���ˮ�Ļ��Һ���״���ˮ���ܣ��е�����������ķ������룬�ʴ�ΪC��
(3)��֪����CH4(g)+2O2(g)=CO2(g)+2H2O(l)��H1=-890.3kJ/mol����2H2(g)+O2(g)�T2H2O(l)��H2=-571.6kJ/mol�����ݸ�˹���ɢ���2-�ٵ�CO2(g)+4H2(g)=CH4(g)+2H2O(l)��H=(-571.6kJ/mol)��2-(-890.3kJ/mol)=-252.9kJ/mol����CO2(g)��H2(g)��Ӧ��CH4(g)��Һ̬ˮ���Ȼ�ѧ����ʽΪCO2(g)+4H2(g) = CH4(g)+2H2O(l) ��H=-252.9kJ/mol��
II��(1)�ӷ�Ӧ��ʼ��20minʱ����CO��Ũ�ȱ仯����x��
CO(g)+2H2(g)CH3OH(g)
��ʼŨ��(mol/L)��0.5 1 �������� 0
�仯Ũ��(mol/L)��x 2x ������ x
ƽ��Ũ��(mol/L)��0.5-x 1-2x ���� x
���ݷ�Ӧǰ��ѹǿ֮�ȵ������ʵ���֮�ȣ���![]() =
=![]() �����x=0.25mol/L���ӷ�Ӧ��ʼ��20minʱ��CO��ʾ��ƽ����Ӧ����v=
�����x=0.25mol/L���ӷ�Ӧ��ʼ��20minʱ��CO��ʾ��ƽ����Ӧ����v=![]() =
=![]() =0.0125 mol��L-1��min-1��
=0.0125 mol��L-1��min-1��
(2)��Ӧ�����������С�ķ��ȷ�Ӧ������ƽ���ƶ�ԭ�������жϣ�
A��װ��������Ϊ��ɫ������˵����Ӧ�ﵽƽ��״̬����A����
B�������������ƽ����Է���������ֵ�ϵ��������ƽ��Ħ�������������������������ʵ������������غ�ı��ֲ��䣬����n�仯���������ƽ��Ħ�����������ˣ�֤���ﵽƽ�⣬��B��ȷ��
C����Ӧ��ǰ����������仯�ķ�Ӧ�������������ѹǿ���ֲ��䣬֤���ﵽ��ƽ�⣬��C��ȷ��
D���÷�Ӧ�ں��������½��У���Ӧǰ�����������غ㣬���Է�Ӧ�������ܶ�ʼ�ձ��ֲ��䣬�����ܶȲ��䲻��˵����Ӧ�ﵽƽ��״̬����D����
�ʴ�ΪBC��
(3)�ӷ�Ӧ��ʼ��20minʱ����CO��Ũ�ȱ仯����x��
CO(g)+2H2(g)CH3OH(g)
��ʼŨ��(mol/L)��0.5 1 �� 0
�仯Ũ��(mol/L)��x 2x �� x
ƽ��Ũ��(mol/L)��0.5-x 1-2x �� x
���ݷ�Ӧǰ��ѹǿ֮�ȵ������ʵ���֮�ȣ�����ݷ�Ӧǰ��ѹǿ֮�ȵ������ʵ���֮�ȣ���![]() =
=![]() �����x=0.25mol/L��K=
�����x=0.25mol/L��K=![]() =4��ƽ�ⳣ�����ĵ۱仯�����ﵽƽ����������CH3OH(g)����ʱƽ�ⳣ��Kֵ�����䣻
=4��ƽ�ⳣ�����ĵ۱仯�����ﵽƽ����������CH3OH(g)����ʱƽ�ⳣ��Kֵ�����䣻
(4)CO(g)+2H2(g)CH3OH(g)���÷�Ӧ�ﵽƽ������������г���1mol CO��2molH2���൱������ƽ��ѹǿ��ƽ��������У�CO��ת���ʽ�����
III�������������������ӷŵ�����������ˮ���缫��ӦʽΪ4OH--4e-�T2H2O+O2����
��HCO3-���ڵ���ƽ�⣺HCO3-H++CO32-������H+�ŵ�Ũ�ȼ�Сƽ�����ƣ�CO32-����������H+�ŵ�OH-Ũ������OH-��HCO3-��Ӧ����CO32-��CO32-������

 ��������ܸ�ϰϵ�д�
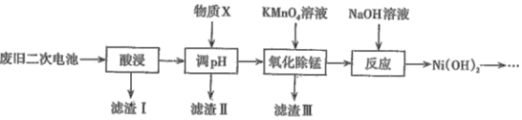
��������ܸ�ϰϵ�д�����Ŀ��2019��ŵ������ѧ���������λΪ����ӵ�ط�չ������Ҫ���Ŀ�ѧ�ҡ����÷Ͼɶ��ε��[��Ҫ�ɷ�ΪNi(OH)2��Fe2O3��MnO2��̼�ۡ�������]�ϳɵ�ؼ�Ni(OH)2�Ĺ����������£�
��֪��
�������� | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Mn(OH)2 |
Ksp(������) | 4.0��10-38 | 1.0��10-33 | 1.6��10-14 | 2.0��10-13 |
(1)����֪�����������Һ�к��У�Ni2+��Al3+��Fe3+��Mn2+��������Һ��pHԼΪ5����Ŀ����__���������ʺ���Ϊ����X����____������ĸ����
A��˫��ˮ B����ˮ C������ D��NiO
������Һ��Ni2+��Ũ��Ϊ2molL-1����ʽ�����жϴ�ʱ���������Ƿ���Ni(OH)2������___ ��
(2)���������Ҫ�ɷ���____�����������������̷�����Ӧ�����ӷ���ʽΪ______��
(3)��Ni(OH)2��LiOH�ڿ����л�ϼ�����700�桫800����Ƶ�LiNiO2������ﮣ����÷�Ӧ�Ļ�ѧ����ʽΪ___________��
(4)�������һ���нϺ�ǰ��������ӵ���������ϡ��õ���ڳ�ŵ�����У�����LiNiO2��Li1-xNiO2֮���ת�������ʱLiNiO2��_______����������������������������Ӧ���õ缫�ĵ缫��ӦʽΪ_____��