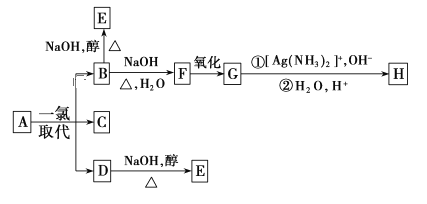
题目内容
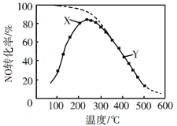
【题目】工业上利用CO2和H2反应生成甲醇,也是减少CO2的一种方法。在容积为 1L 的恒温密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示:
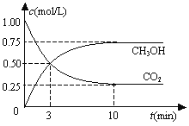
(1)达到平衡的时刻是_________min(填“3”或“10”)。在前10min内,用CO2浓度的变化表示的反应速率υ(CO2)=_________mol/(L· min)。
(2)能判断该反应达到化学平衡状态的依据是_________。
a.容器内压强不变 b.混合气体中c(CO2)不变 c.υ(CH3OH)=υ(H2O) d.c(CH3OH)=c(H2O)
(3)达平衡后,H2的转化率是_________。平衡常数 K =_________(计算结果保留一位小数)。为了提高H2的转化率,可采取_________(填“增大”或“减小”)CO2浓度的措施。
(4)工业上也可用 CO 和H2合成甲醇
已知:①CO(g) + ![]() O2(g) = CO2(g) △H1=-283.0 kJ/mol
O2(g) = CO2(g) △H1=-283.0 kJ/mol
②H2(g) + ![]() O2(g) = H2O(g) △H2=-241.8 kJ/mol
O2(g) = H2O(g) △H2=-241.8 kJ/mol
③CH3OH(g) + ![]() O2(g) = CO2(g)+2H2O(g) △H3=-673kJ/mol
O2(g) = CO2(g)+2H2O(g) △H3=-673kJ/mol
则反应CO(g) + 2H2(g) = CH3OH(g)△H=_________kJ/mol
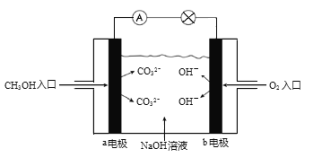
(5)如图是甲醇燃料电池原理示意图,电池正极的电极反应式为:_________。
【答案】10 0.075 ab 75% 5.3 增大 -93.6 ![]()
【解析】
(1)达到平衡时是物质的浓度保持不变而不是相等,故平衡的时刻是10min,在前10min内,用 CO2浓度的变化表示的反应速率 υ(CO2)=![]() ,故答案为:10 0.075
,故答案为:10 0.075
(2) a.该反应的正反应气体分子数减小,建立平衡过程中气体分子物质的量是变化的,在恒容容器中,容器内的压强是变化的,故容器内压强不变能说明反应达到平衡状态;
b.混合气体中c(CO2)不变是反应达到平衡状态的特征;
c.υ(CH3OH)=υ(H2O) 没有指明反应速率的方向,不能说明正、逆反应速率相等,不能说明反应达到平衡状态;
d.从正反应开始建立平衡的过程中c(CH3OH)与c(H2O)始终相等,c(CH3OH)与c(H2O)不能说明反应达到平衡状态;
故答案为:ab;
(3)通过化学平衡三段式进行计算,可知:
H2的转化率=![]() ;平衡常数
;平衡常数 ![]() ;增大一种反应物的浓度,另一种反应物的转化率增大,故为了提高 H2 的转化率,可采取增大CO2 浓度,故答案为:75% 5.3 增大;
;增大一种反应物的浓度,另一种反应物的转化率增大,故为了提高 H2 的转化率,可采取增大CO2 浓度,故答案为:75% 5.3 增大;
(4) ①CO(g) + ![]() O2(g) = CO2(g) △H1=-283.0 kJ/mol
O2(g) = CO2(g) △H1=-283.0 kJ/mol
②H2(g) + ![]() O2(g) = H2O(g) △H2=-241.8 kJ/mol
O2(g) = H2O(g) △H2=-241.8 kJ/mol
③CH3OH(g) + ![]() O2(g) = CO2(g)+2H2O(g) △H3=-673 kJ/mol
O2(g) = CO2(g)+2H2O(g) △H3=-673 kJ/mol
根据盖斯定律,将①+2×②-③即得到反应 CO(g) + 2H2(g) = CH3OH(g)![]() ,故答案为:-93.6;
,故答案为:-93.6;
(5)根据甲醇燃料电池原理示意图,电解质是NaOH溶液,故电池正极的电极反应式为:![]() ,故答案为:
,故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案