题目内容
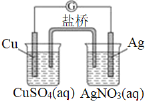
【题目】图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

(1) 腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
(2) 环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 ;
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标况)。
【答案】(1)c;
(2)2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
(3)0.448。
【解析】
试题分析:(1)根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极,即c是负极,故答案为:c;
(2)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
(3)n[Cu2(OH)3Cl]=![]() =0.02mol,根据转移电子得n(O2)=
=0.02mol,根据转移电子得n(O2)=![]() =0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,故答案为:0.448。
=0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,故答案为:0.448。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2D(g)△H=QkJ/mol。相关条件和数据见下表:
2D(g)△H=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验I | 实验II | 实验III |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 50 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是
A. 升高温度能加快反应速率的原理是降低了反应的活化能,使活化分子百分数提高
B. 实验III达平衡后,保持其他条件不变,再向容器中通入1molA和1molD,平衡不移动
C. 实验III达平衡后容器内的压强是实验1的9/10倍
D. K3>K2>K1