题目内容
【题目】Na2CO3和NaHCO3是中学化学中常见的物质,在生产生活中有重要的用途
(1)常温下,0.1mol/L碳酸钠溶液pH约为12。原因是_____(用离子方程式表示)。
(2)若在FeCl3溶液中加入碳酸氢钠浓溶液,观察到红褐色沉淀和无色气体,用离子方程式解释产生该现象的原因________。
(3)工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,再经过处理最终得到Pb。
①PbCO3的溶解度______PbSO4(填“大于”或“小于”)。
②用离子方程式解释Na2CO3的作用________。
③用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大。原因是________。
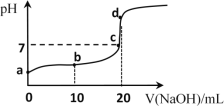
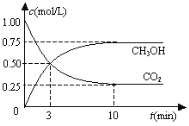
(4)25℃时,在10mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示:

①请写出OAB段的离子方程式________。
②当pH=7时,溶液中主要含有哪些离子________。(除H+和OH-外)
【答案】![]() +H2O
+H2O![]() +OH 3
+OH 3![]() +Fe3+=Fe(OH)3↓+3CO2↑ 小于 PbSO4(s)+
+Fe3+=Fe(OH)3↓+3CO2↑ 小于 PbSO4(s)+![]() PbCO3(s)+
PbCO3(s)+![]() 等体积等浓度的Na2CO3和NaHCO3溶液,由于碳酸氢根的电离程度小,导致碳酸根离子浓度小,而碳酸钠溶液中碳酸根浓度大,所以碳酸钠使得PbSO4(s)+
等体积等浓度的Na2CO3和NaHCO3溶液,由于碳酸氢根的电离程度小,导致碳酸根离子浓度小,而碳酸钠溶液中碳酸根浓度大,所以碳酸钠使得PbSO4(s)+![]() PbCO3(s)+
PbCO3(s)+![]() 向正方向移动的程度更大,即Na2CO3溶液中的PbSO4转化率大
向正方向移动的程度更大,即Na2CO3溶液中的PbSO4转化率大 ![]() +H+=
+H+=![]() Na+、Cl-、
Na+、Cl-、![]()
【解析】
(1)碳酸钠溶液中碳酸根离子水解,使得溶液显碱性;
(2)在FeCl3溶液中加入碳酸氢钠浓溶液,二者发生双水解反应,生成氢氧化铁红褐色沉淀和二氧化碳无色气体;
(3)用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,发生了沉淀的转化,PbSO4+ Na2CO3![]() PbCO3+ Na2SO4,结合平衡移动的影响因素分析解答;
PbCO3+ Na2SO4,结合平衡移动的影响因素分析解答;
(4)根据图象,随着盐酸的加入,![]() 逐渐减少,
逐渐减少,![]() 逐渐增多,到B点时,
逐渐增多,到B点时,![]() 完全反应,
完全反应,![]() 达到最多,随后
达到最多,随后![]() 逐渐减少,碳酸分子逐渐增多,据此分析解答。
逐渐减少,碳酸分子逐渐增多,据此分析解答。
(1)常温下,0.1mol/L碳酸钠溶液中碳酸根离子水解,使得溶液显碱性,水解的离子方程式为![]() +H2O
+H2O![]() +OH,故答案为:
+OH,故答案为:![]() +H2O
+H2O![]() +OH;
+OH;
(2)在FeCl3溶液中加入碳酸氢钠浓溶液,二者发生双水解反应,生成氢氧化铁红褐色沉淀和二氧化碳无色气体,反应的离子方程式为3![]() +Fe3+=Fe(OH)3↓+3CO2↑,故答案为:3
+Fe3+=Fe(OH)3↓+3CO2↑,故答案为:3![]() +Fe3+=Fe(OH)3↓+3CO2↑;
+Fe3+=Fe(OH)3↓+3CO2↑;
(3)①用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,发生了沉淀的转化:PbSO4+ Na2CO3+PbCO3+ Na2SO4,说明PbCO3的溶解度小于PbSO4,故答案为:小于;
②用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,发生了沉淀的转化:PbSO4+ Na2CO3 PbCO3+ Na2SO4,离子方程式为PbSO4(s)+![]() PbCO3(s)+
PbCO3(s)+![]() ,故答案为:PbSO4(s)+
,故答案为:PbSO4(s)+![]() PbCO3(s)+
PbCO3(s)+![]() ;
;
③等体积、等浓度的Na2CO3和NaHCO3溶液中,Na2CO3中的c(CO32-)大,能够使PbSO4(s)+![]() PbCO3(s)+
PbCO3(s)+![]() 的平衡正向移动的程度增大,因此Na2CO3溶液中的PbSO4转化率较大,故答案为:等体积等浓度的Na2CO3和NaHCO3溶液,由于碳酸氢根的电离程度小,导致碳酸根离子浓度小,而碳酸钠溶液中碳酸根浓度大,所以碳酸钠使得PbSO4(s)+
的平衡正向移动的程度增大,因此Na2CO3溶液中的PbSO4转化率较大,故答案为:等体积等浓度的Na2CO3和NaHCO3溶液,由于碳酸氢根的电离程度小,导致碳酸根离子浓度小,而碳酸钠溶液中碳酸根浓度大,所以碳酸钠使得PbSO4(s)+![]() PbCO3(s)+
PbCO3(s)+![]() 向正方向移动的程度更大,即Na2CO3溶液中的PbSO4转化率大;
向正方向移动的程度更大,即Na2CO3溶液中的PbSO4转化率大;
(4)①根据图象,随着盐酸的加入,![]() 逐渐减少,
逐渐减少,![]() 逐渐增多,到B点时,
逐渐增多,到B点时,![]() 完全反应,
完全反应,![]() 达到最多,随后
达到最多,随后![]() 逐渐减少,碳酸分子逐渐增多,因此OAB段碳酸钠与盐酸反应生成碳酸氢钠,反应的离子方程式为
逐渐减少,碳酸分子逐渐增多,因此OAB段碳酸钠与盐酸反应生成碳酸氢钠,反应的离子方程式为![]() +H+=
+H+=![]() ,故答案为:
,故答案为:![]() +H+=
+H+=![]()
②根据图象,当pH=7时,碳酸钠完全转化为碳酸氢钠,且部分碳酸氢钠与盐酸反应生成了碳酸,此时溶液中主要存在碳酸氢钠、氯化钠和碳酸,存在的离子主要有Na+、Cl-、![]() ,故答案为:Na+、Cl-、
,故答案为:Na+、Cl-、![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】在25℃时,体积一定的密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.反应达到平衡时,X的转化率为50%
D.反应起始时和达平衡时的压强比为3:2