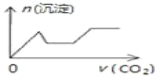
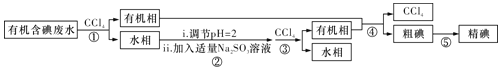
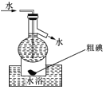
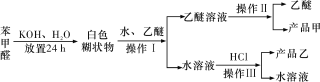
��Ŀ����
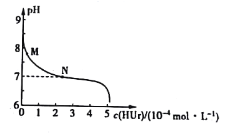
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ����,������������Ϣ���ɡ��±����������ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ�(��֪��Ԫ�ص�ԭ�Ӱ뾶Ϊ0.089 nm)��
Ԫ�ش��� | A | B | C | D | X | Y |
ԭ�Ӱ뾶/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
��Ҫ���ϼ� | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)CԪ�������ڱ��е�λ��Ϊ___�� �����ӽṹʾ��ͼΪ��____��
(2)B������������Ӧ��ˮ������Y������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ____��
(3)����C��D ����Ԫ��˵����ȷ����_________(�����)
a�������ӵİ뾶D>C b����̬�⻯����ȶ���D��Cǿ c������������Ӧ��ˮ���������C��Dǿ
(4)д����A��D��X����Ԫ����ɵ�ij�ֿ�������ɱ�����ʵĵ���ʽ_____________��
(5)�Ƚ�YԪ������ͬ�������Ԫ�ص��⻯����ȶ��� _______(���⻯�ﻯѧʽ)��
���𰸡���������VIA�� 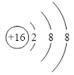 Al(OH)3+3H+=Al3++3H2O b
Al(OH)3+3H+=Al3++3H2O b ![]() NH3>PH3
NH3>PH3
��������
����ԭ�Ӱ뾶��ͬһ���ڴ����������μ�С��ͬһ���������������������Ҫ�����ϼ۵�������Ԫ�ص������������ȹ��ɣ��ٽ�ϱ������ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼۣ������Ƶ���A��B��C��D��X��Y�ֱ���H��Al��S��Cl��O��N����Ԫ�أ��ٽ��н���Ͳ����ˡ�
(1)CԪ������Ԫ�أ�������3�����Ӳ㣬�������6�����ӣ��������ڱ��е�λ��Ϊ��������VIA�壬�����ӽṹʾ��ͼΪ![]() ���ʴ�Ϊ����������VIA��
���ʴ�Ϊ����������VIA�� ![]() ��
��
(2)B������������Ӧ��ˮ���TAl(OH)3��Y������������Ӧ��ˮ���THNO3�ʷ�Ӧ�����ӷ���ʽΪAl(OH)3+3H+=Al3++3H2O���ʴ�Ϊ��Al(OH)3+3H+=Al3++3H2O��
(3)a�������ӵİ뾶S2->Cl-����a����b����̬�⻯����ȶ���HCl��H2Sǿ����b��ȷ��c������������Ӧ��ˮ���������HClO4��H2SO4ǿ,��c���ʴ�Ϊ��b��
(4)��H��Cl��O����Ԫ����ɵ�ij�ֿ�������ɱ�����ʼ�HClO�������ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(5)����ͬ����������£�Ԫ�صķǽ��������μ��������⻯����ȶ���Ҳ���μ�������NԪ������ͬ�������Ԫ��P���⻯����ȶ���ǿ��˳��ΪNH3>PH3���ʴ�Ϊ��NH3>PH3��