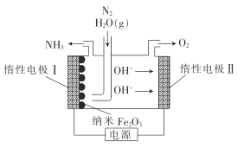
题目内容
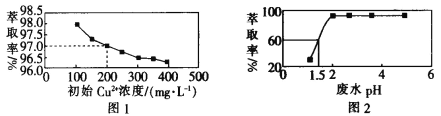
【题目】在密闭容器中充入一定量的NO2,发生反应2NO2(g)![]() N2O4(g)ΔH=﹣57 kJmol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
N2O4(g)ΔH=﹣57 kJmol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
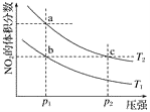
A. a、c两点的反应速率:a>cB. a、b两点的转化率:a<b
C. a、c两点气体的颜色:a深,c浅D. 由a点到b点,可以用加热的方法
【答案】B
【解析】
2NO2(g) ![]() N2O4(g)△H=-57kJmol-1,该反应为放热反应,升高温度,平衡逆向移动,混合气体中NO2的体积分数增大;增大压强,平衡正向移动,混合气体中NO2的体积分数减小,然后结合图象分析解答。
N2O4(g)△H=-57kJmol-1,该反应为放热反应,升高温度,平衡逆向移动,混合气体中NO2的体积分数增大;增大压强,平衡正向移动,混合气体中NO2的体积分数减小,然后结合图象分析解答。
A.由图像可知,a、c两点都在等温线上,c的压强大,则a、c两点的反应速率:a<c,故A错误;
B.由图像可知,a点二氧化氮的体积分数高,所以转化率a<b,故B正确;
C.a、c两点温度相同,c点压强大,c点容器体积小,则二氧化氮浓度大,因此a、c两点气体的颜色:a浅、c深,故C错误;
D.升高温度,平衡逆向移动,NO2的体积分数增大,a点到b点,二氧化氮的体积分数减少,说明是降低了温度,所以不能用加热的方法实现由a点到b点的转变,故D错误;
答案选B。

【题目】I.下面列出了几组物质,请用物质的组号填写下表。
类型 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
组号 | __ | __ | __ | __ |
① ![]() 与
与![]() ②
② ![]() 与
与![]() ③金刚石和石墨 ④12C、13C、14C ⑤
③金刚石和石墨 ④12C、13C、14C ⑤![]() 和
和![]()
II.下图中A、B、C 分别是三种烃的结构模型:

请回答下列问题:
(1)A 的电子式______________,B 的结构简式________________。
(2)A及其同系物的分子式符合通式_____________(用 n 表示)。当 n=____________时,烷烃开始出现同分异构体;当 n=6 时,同分异构体有__________种。
(3)A、B、C 三种有机物中,所有原子均共面的是___________(填名称)。结构简式为 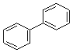 的有机物中,处于同一平面内的原子数最多为__________,处于 同一平面内的碳原子数至少为____________。
的有机物中,处于同一平面内的原子数最多为__________,处于 同一平面内的碳原子数至少为____________。
(4)有机物 C 不具有的结构或性质是_____________(填字母序号)。
a.是碳碳双键和碳碳单键交替的结构 b.有毒、不溶于水、密度比水小
c.不能使酸性 KMnO4 溶液和溴水反应褪色 d.一定条件下能与氢气或氧气反应
(5)等质量的三种有机物完全燃烧生成 H2O 和 CO2,消耗氧气的体积(相同状况下)最大的是_______(填A 或B 或 C)。
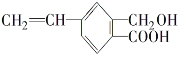
III.某有机物的结构简式如图,1mol 该有机物最多可以和______mol氢气反应,最多可以和_____molNaOH 反应。
【题目】某化学实验小组将装有铜与浓硫酸烧瓶加热一段时间后,取出烧瓶中固体,探究其成分。查资料可知,浓硫酸与铜反应可能生成CuS或Cu2S,它们都难溶于水,能溶于稀硝酸。实验如下:
(i)用蒸馏水洗涤固体,得到蓝色溶液,固体呈黑色。
(ii)取少量黑色固体于试管中,加入适量稀硝酸,黑色固体逐渐溶解,溶液变为蓝色,产生无色气泡。取少量上层清液于试管,滴加氯化钡溶液,产生白色沉淀。
①根据实验(i)得到蓝色溶液可知,固体中含____________(填化学式)
②根据实验(ii)的现象_______(填“能”或“不能”)确定黑色固体是CuS还是Cu2S,理由是__________________________________________________________________________。
写出Cu2S与稀硝酸反应的化学方程式____________________________________________
③为了进一步探究黑色固体的成分,将实验(i)中黑色固体洗涤、烘干,再称取48.0g黑色固体进行如下实验,通入足量O2,使硬质玻璃管中黑色固体充分反应,观察到F瓶中品红溶液褪色。

实验序号 | 反应前黑色固体质量/g | 充分反应后黑色固体质量/g |
I | 48.0 | 48.0 |
Ⅱ | 48.0 | 44.0 |
Ⅲ | 48.0 | 40.0 |
根据上表实验数据推测:实验I中黑色固体的化学式为_____________________________;实验Ⅱ中黑色固体的成分及质量为_______________________________________________。
【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是六种短周期元素的原子半径及主要化合价(已知铍元素的原子半径为0.089 nm)。
元素代号 | A | B | C | D | X | Y |
原子半径/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)C元素在周期表中的位置为___, 其离子结构示意图为:____。
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为____。
(3)关于C、D 两种元素说法正确的是_________(填序号)
a.简单离子的半径D>C b.气态氢化物的稳定性D比C强 c.最高价氧化物对应的水化物的酸性C比D强
(4)写出由A、D、X三种元素组成的某种可以消毒杀菌物质的电子式_____________。
(5)比较Y元素与其同族短周期元素的氢化物的稳定性 _______(填氢化物化学式),