题目内容
【题目】某兴趣小组在实验室模拟反应![]() 制备重要的化工原料
制备重要的化工原料![]() 。
。
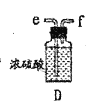
已知:![]() 熔点-93.6℃,沸点76.1℃,遇水极易水解,易与
熔点-93.6℃,沸点76.1℃,遇水极易水解,易与![]() 反应;
反应;![]() 熔点1.25℃,沸点105.8℃,遇水强烈水解,能溶于
熔点1.25℃,沸点105.8℃,遇水强烈水解,能溶于![]() 。
。
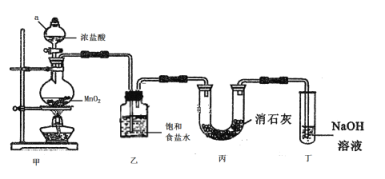
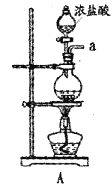
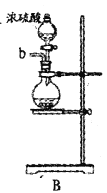
(1)装置A中发生反应的离子方程式是__________________。
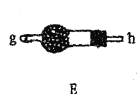
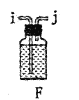
(2)以上各仪器接口的连接顺序是a→____→____→____→____→cd←g←h←b,装置E中的试剂为无水氯化钙,F中所装的试剂是________。(仪器不重复使用)
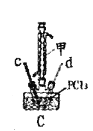
(3)装置C制备![]() 。
。
①仪器甲的名称是_______。
②反应温度控制在60~65℃,其原因是______________。
③![]() 发生水解反应生成
发生水解反应生成![]() 和_____________。
和_____________。
(4)该装置不足之处是_____________。
【答案】4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O i j e f 饱和食盐水 球形冷凝管 温度太低,反应速率太慢;因为
Mn2++Cl2↑+2H2O i j e f 饱和食盐水 球形冷凝管 温度太低,反应速率太慢;因为![]() 沸点是76.1℃,温度太高
沸点是76.1℃,温度太高![]() 、
、![]() 挥发 SO2 缺少尾气处理装置
挥发 SO2 缺少尾气处理装置
【解析】
A装置制备氯气,其中混有氯化氢和水蒸气,需要经过F装置中饱和食盐水除去氯化氢,通过D装置的浓硫酸干燥,再通入C中,由装置B制取二氧化硫,需通过E中干燥剂干燥后在通入C中反应,加热条件下发生PCl3+SO2+Cl2![]() POCl3+SOCl2,以此解答。
POCl3+SOCl2,以此解答。
(1)A用于制备氯气,发生反应的离子方程式为4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)由以上分析可知连接顺序为a→i→j→e→f→cd←g←h←b,E应盛放固体干燥剂,F用于除去氯气中的氯化氢,可用饱和食盐水(或饱和NaCl溶液);
(3)①由仪器的结构和性能可知仪器甲为冷凝管;
②B中反应温度控制在60~65℃,因为温度过高,PCl3、SO2会大量挥发,导致产量降低,温度过低,反应速率会变慢;
③SOCl2发生水解反应生成二氧化硫和盐酸,化学方程式是SOCl2+H2O=SO2↑+2HCl;
(4)含有SO2的尾气对环境有污染,需要添加尾气处理装置。

【题目】面对全球近期的气候异常,环境问题再次成为焦点。SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径。
(1)已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2 (g)+3H2O(g) ΔH3=-Q3 kJ/mol
则23g液态酒精完全燃烧并恢复至室温放出的热量为________________kJ。
(2)下表为反应2SO2(g)+O2 (g)![]() 2SO3(g)的相应温度下平衡常数的数值,由此得出该反应的ΔH__________0(填“>”“=”或“<”)。
2SO3(g)的相应温度下平衡常数的数值,由此得出该反应的ΔH__________0(填“>”“=”或“<”)。
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 2.6 | 1.9 | 1.0 | 0.7 | 0.6 |
(3)①已知:在2L密闭容器中,17℃、1.01×105Pa条件下,2NO2(g)![]() N2O4(g) ΔH<0的平衡常数K=13.3。当此反应达到平衡时,若n(NO2)=0.060mol,则c(N2O4)=_______(保留两位有效数字)。
N2O4(g) ΔH<0的平衡常数K=13.3。当此反应达到平衡时,若n(NO2)=0.060mol,则c(N2O4)=_______(保留两位有效数字)。
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.040mol/L,c(N2O4)=0.0070mol/L,则改变的条件是______________。