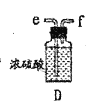题目内容
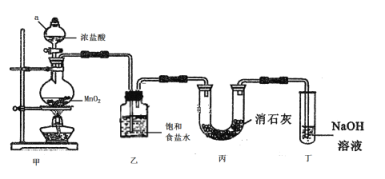
【题目】某兴趣小组模拟工业制漂白粉,设计了如下图所示的实验装置。
已知:①氯气与碱反应放出热量。②6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O。
试回答下列问题:
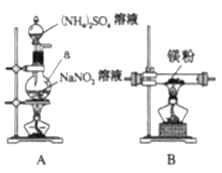
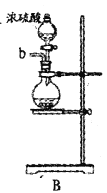
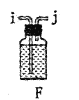
(1)甲装置中仪器a的名称是________________________。
(2)装置乙中饱和食盐水的作用是________________________。
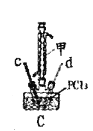
(3)装置丁中发生反应的化学方程式为_____________________。
(4)漂白粉在空气中失效的原因是______________、______________(用化学方程式表示)。
(5)①该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],其主要原因是________ 。
②为提高Ca(ClO)2的含量。可采取的措施是___________(任写一种即可)。
【答案】分液漏斗 吸收 HCl气体 Cl2+2NaOH=NaCl+NaClO+H2O Ca(ClO)2+CO2+H2O=CaCO3+2HClO 2HClO![]() 2HCl+O2↑。 氯气与碱反应会放出热量,导致温度升高,发生副反应6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O 将丙装置浸在盛有冷水的水槽中或控制氯气产生速率
2HCl+O2↑。 氯气与碱反应会放出热量,导致温度升高,发生副反应6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O 将丙装置浸在盛有冷水的水槽中或控制氯气产生速率
【解析】
模拟工业制漂白粉:装置A制取Cl2,a为分液漏斗,可以控制加入浓盐酸,在圆底烧瓶中盛放MnO2,反应产生Cl2。由于HCl易挥发,使制得的Cl2中含有杂质HCl及水蒸气,可以用乙装置的饱和食盐水来除HCl,在丙装置中Cl2与Ca(OH)2的反应制取漂白粉,Cl2有毒,排放前需进行尾气处理,装置丁用NaOH溶液吸收多余的氯气。漂白粉有效成分为次氯酸钙,会与空气中的水、CO2作用生成HClO而导致变质,并且HClO见光分解生成盐酸和氧气;
(5)①根据氯气和碱反应放出热量,温度稍高即发生副反应6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O进行判断;
②因为温度高时易生成Ca(ClO3)2,所以避免此反应发生可以采取降温措施或控制反应避免反应放热瞬时升高。
(1)根据甲装置中仪器a具有的特征可知该仪器为分液漏斗;
(2)浓盐酸和MnO2混合加热制取Cl2,反应的方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,浓盐酸具有挥发性,使Cl2中混有HCl、H2O蒸气,HCl在饱和食盐水中易溶,而氯气难溶,通过饱和食盐水的作用是除去Cl2中混有的HCl气体,故合理答案为:吸收HCl;
MnCl2+Cl2↑+2H2O,浓盐酸具有挥发性,使Cl2中混有HCl、H2O蒸气,HCl在饱和食盐水中易溶,而氯气难溶,通过饱和食盐水的作用是除去Cl2中混有的HCl气体,故合理答案为:吸收HCl;
(3)在装置丁中Cl2和NaOH反应生成氯化钠、次氯酸钠和水,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O;
(4)漂白粉有效成分为Ca(ClO)2,Ca(ClO)2容易与空气中的水、CO2作用生成HClO和CaCO3,同时,产生的HClO见光分解生成盐酸和氧气,因此反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(5)①氯气和石灰乳发生反应制取漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,该反应是放热反应,反应会放出的热量,导致物质温度升高。因此当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙和水;当温度高时,发生了副反应:6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O,使得制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2];
②温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却,或控制氯气产生速率,通过控制反应速率,避免反应放热瞬时升高,故合理答案为:将丙装置浸在盛有冷水的水槽中或控制氯气产生速率。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D