题目内容
【题目】如图甲、乙是电化学实验装置.
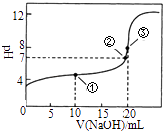
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液.①甲中石墨棒上的电极反应式 , 电子的移动方向为 .
②乙中总反应的离子方程式为 , Cl﹣移向电极(填Fe或C).
③将湿润的淀粉﹣KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2 . 若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为: .
(2)如果起始时乙中盛有200mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入CuO的质量为 .
【答案】
(1)O2+2H2O+4e﹣═4OH﹣;由铁经导线移向石墨;2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑;C;5Cl2+I2+6H2O═10HCl+2HIO3
2OH﹣+H2↑+Cl2↑;C;5Cl2+I2+6H2O═10HCl+2HIO3
(2)0.8g
【解析】解:(1)①甲为原电池装置,石墨棒是正极,铁是负极,正极上氧气得电子发生还原反应,反应为2H2O+O2+4e﹣═4OH﹣ , 电子的移动方向为:负极到正极,即由铁经导线移向石墨,所以答案是:2H2O+O2+4e﹣═4OH﹣;由铁经导线移向石墨;②乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,则电解反应为2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣ , 在电解池中,阴离子移向阳极,即氯离子流向C电极.所以答案是:2Cl﹣+2H2O
H2↑+Cl2↑+2OH﹣ , 在电解池中,阴离子移向阳极,即氯离子流向C电极.所以答案是:2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣;C;③Cl2氧化了生成的I2 , Cl元素的化合价降低,生成盐酸,反应中Cl2和I2的物质的量之比为5:1,设I元素的化合价为x,则5×2×1=1×2×x,解得x=+5,则生成碘酸,所以发生的化学反应为5Cl2+I2+6H2O═10HCl+2HIO3 , 所以答案是:5Cl2+I2+6H2O═10HCl+2HIO3;(2)由2CuSO4+2H2O
H2↑+Cl2↑+2OH﹣;C;③Cl2氧化了生成的I2 , Cl元素的化合价降低,生成盐酸,反应中Cl2和I2的物质的量之比为5:1,设I元素的化合价为x,则5×2×1=1×2×x,解得x=+5,则生成碘酸,所以发生的化学反应为5Cl2+I2+6H2O═10HCl+2HIO3 , 所以答案是:5Cl2+I2+6H2O═10HCl+2HIO3;(2)由2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4 , 要使溶液恢复原状态,可加入CuO(或CuCO3),一段时间后溶液的pH变为1,则c(H+)=0.1mol/L﹣10﹣5mol/L=0.1mol/L,n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,m(CuO)=0.01mol×80g/mol=0.8g,
2Cu+O2↑+2H2SO4 , 要使溶液恢复原状态,可加入CuO(或CuCO3),一段时间后溶液的pH变为1,则c(H+)=0.1mol/L﹣10﹣5mol/L=0.1mol/L,n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,m(CuO)=0.01mol×80g/mol=0.8g,
所以答案是:0.8g.

【题目】已知:反应I:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H1反应Ⅱ:2NO(g)+O2(g)2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)5N2(g)+3O2(g)+6H2O(l)△H 3
反应I和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)△H3=(用△H1、△H2的代数式表示);推测反应Ⅲ是反应(填“吸热”或“放热”)
(2)相同条件下,反应I:4NH3(g)+6NO(g)5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示. ①计算0~4分钟在A催化剂作用下,反应速率V(NO)= .
②下列说法不正确的是 .
A.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2. ①保持恒温恒容,再充入NO2气体,NO2体积分数(填“变大”、“变小”或“不变”)
②关于平衡体系反应Ⅱ:2NO(g)+O2(g)2NO2(g);△H2说法正确的是 .
A、该反应焓变为负值
B、升高温度,逆反应速率增大,正反应速率减小,反应逆向移动
C、不论增大压强还是减小压强,正方向速率改变的程度更大
D、平衡正向移动,NO的转化率一定增大
E、平衡体系中加入NO2 , 平衡逆向移动,△H2减小
F、混合气体颜色加深说明平衡向右移动,颜色变浅则向左移动.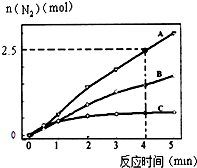
【题目】铜、铬都是用途广泛的金属.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如图: 
已知:部分物质沉淀的pH如表:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |
请回答下列问题:
(1)滤液I中所含溶质主要有(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为 , 然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为 .
(3)当离子浓度≤1×10﹣5molL﹣1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为 . (已知:Kap[Cr(OH)3]=6.3×10﹣31 , ![]() ≈4.0;lg4=0.6)
≈4.0;lg4=0.6)
(4)Cr(OH)3受热分解为Cr2O3 , 用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式 .