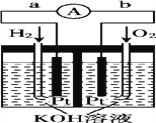
题目内容
【题目】常温下,用0.1000molL﹣1NaOH溶液滴定 20.00mL0.1000molL﹣1CH3COOH溶液滴定曲线如图.下说法正确的是( ) 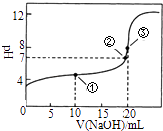
A.点①所示溶液中:c(CH3COOH)+c(CH3COO﹣)>2c(Na+)
B.点③所示溶液中:c(Na+)>c(OH﹣)>c(CH3COO﹣)>c(H+)
C.点③所示溶液中:c(CH3COO﹣)>c(Na+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(Na+)>c(OH﹣)
【答案】D
【解析】解:A.点①反应掉一半醋酸,反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,CH3COOH电离程度大于CH3COO﹣的水解程度,溶液中物料守恒得到2c(Na+)=c(CH3COOH)+c(CH3COO﹣),故A错误;B.点③说明两溶液恰好完全反应生成CH3COONa,因CH3COO﹣水解,且程度较小,c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+),故B错误;
C.点③说明两溶液恰好完全反应生成CH3COONa,因CH3COO﹣水解,c(CH3COO﹣)<c(Na+),故C错误;
D.当CH3COOH较多,滴入的碱较少时,则生成CH3COONa少量,可能出现c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(Na+)>c(OH﹣),故D正确;
故选D.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目