题目内容
【题目】已知:反应I:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H1反应Ⅱ:2NO(g)+O2(g)2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)5N2(g)+3O2(g)+6H2O(l)△H 3
反应I和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)△H3=(用△H1、△H2的代数式表示);推测反应Ⅲ是反应(填“吸热”或“放热”)
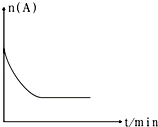
(2)相同条件下,反应I:4NH3(g)+6NO(g)5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示. ①计算0~4分钟在A催化剂作用下,反应速率V(NO)= .
②下列说法不正确的是 .
A.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2. ①保持恒温恒容,再充入NO2气体,NO2体积分数(填“变大”、“变小”或“不变”)
②关于平衡体系反应Ⅱ:2NO(g)+O2(g)2NO2(g);△H2说法正确的是 .
A、该反应焓变为负值
B、升高温度,逆反应速率增大,正反应速率减小,反应逆向移动
C、不论增大压强还是减小压强,正方向速率改变的程度更大
D、平衡正向移动,NO的转化率一定增大
E、平衡体系中加入NO2 , 平衡逆向移动,△H2减小
F、混合气体颜色加深说明平衡向右移动,颜色变浅则向左移动.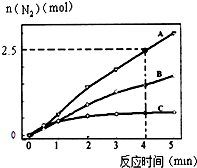
【答案】
(1)△H1﹣3△H2;吸热
(2)0.375mol?L﹣1?min﹣1;CD
(3)变大;AC
【解析】解:(1)已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,△H1<0;K2>K2′,说明随温度升高,K减小,则反应II为放热反应,△H2<0;反应I﹣反应II×3得到反应III,则△H3=△H1﹣3△H2 , 已知|△H1|=2|△H2|,所以△H3=△H1﹣3△H2=|△H2|>0,即反应III为吸热反应,所以答案是:△H1﹣3△H2;吸热;(2)①已知4分钟时氮气为2.5mol,则消耗的NO为3mol,所以v(NO)= ![]() =
= ![]() =0.375molL﹣1min﹣1 , 所以答案是:0.375molL﹣1min﹣1;②A.单位时间内H﹣O键断裂表示逆速率,N﹣H键断裂表示正速率,单位时间内H﹣O键与N﹣H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故A不选;
=0.375molL﹣1min﹣1 , 所以答案是:0.375molL﹣1min﹣1;②A.单位时间内H﹣O键断裂表示逆速率,N﹣H键断裂表示正速率,单位时间内H﹣O键与N﹣H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故A不选;
B.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故B不选;
C.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故C选;
D.增大压强能使反应速率加快,是因为增大了活化分子数,而活化分子百分数不变,故D选;
所以答案是:CD;(3)①一定条件下,反应II2NO(g)+O2(g)2NO2(g)达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,若恒温恒容容器中,再充入NO2气体,容器中压强增大,与原来平衡相比较,平衡正向移动,则NO2体积分数变大,
所以答案是:变大;②关于平衡体系反应Ⅱ:2NO(g)+O2(g)2NO2(g),△H2 ,
A、该反应是一氧化氮和氧气发生的化合反应为放热反应,焓变为负值,故A错误;
B、升高温度,正逆反应速率都增大,平衡逆向进行,故B错误;
C、增大压强平衡向气体体积减小的分析进行,减小压强平衡向气体体积增大的方向进行,不论增大压强还是减小压强,正方向速率改变的程度更大,故C正确;
D、平衡正向移动,NO的转化率不一定增大,如增大NO的浓度平衡正向进行,NO转化率减小,故D错误;
E、平衡体系中加入NO2 , 平衡逆向移动,反应焓变△H2和条件改变无关,故E错误;
F、增大二氧化氮浓度平衡左移,最后达到平衡状态混合气体颜色会加深,故F错误;
所以答案是:AC.
【考点精析】通过灵活运用化学平衡状态本质及特征,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.

【题目】铜、铬都是用途广泛的金属.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如图甲,已知:部分物质沉淀的pH如表:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |
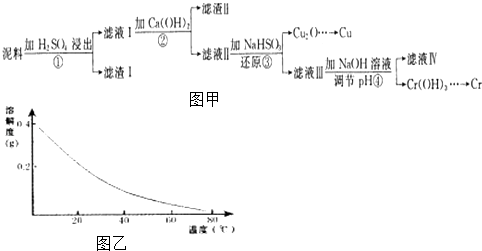
CaSO4的溶解度曲线如图乙,请回答下列问题:
(1)滤液I中所含溶质主要有(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为 , 然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为 .
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式
(4)当离子浓度≤1×10﹣5molL﹣1l时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为 . (已知Kap[Cr(OH)3]=6.3×10﹣31 , ![]() ≈4.0;lg4=0.6)
≈4.0;lg4=0.6)
(5)Cr(OH)3受热分解为Cr2O3 , 用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式 .
【题目】已知A(g)+B(g)C(g)+D(s)反应的平衡常数与温度的关系如下:
温度℃ | 700 | 800 | 880 | 1000 | 1200 |
平衡常数 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“>、<、或=”);
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01molL﹣1min﹣1 , 则2min时c(A)=molL﹣1 , C的物质的量为mol;若经过一段时间后,反应达到平衡时再向容器中充入0.4molA,则再次达到平衡后A的百分含量与第一次平衡相比(填“增大”、“减小”、或“不变”)
(3)下列选项中能作为判断反应达到平衡的依据有 a.压强不随时间改变
b.v(A):v(b)=1:1
c.单位时间内消耗A和B的物质的量相等
d.C的百分含量保持不变
(4)880℃ 时,反应 C(g)+D(s)A(g)+B(g)的平衡常数的值为 .
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),则该此时的温度为℃.
(6)图是1000℃时容器中A的物质的量的变化曲线,请在图中补画出该反应在1200℃时A的物质的量的变化曲线图 .