��Ŀ����
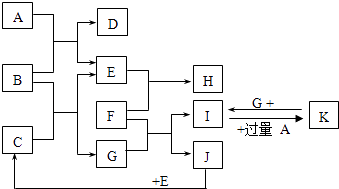
����Ŀ�����ֶ�����Ԫ��A��B��C��D��E��F��ԭ��������������A��Dͬ�壬C��Eͬ�壬D���Ӻ�C���Ӿ�����ͬ�ĵ��Ӳ�ṹ��A��C��E��F�����γɹ����ͻ����A��C�γɵĻ�������ˮ�гʼ��ԣ�D��F�γɵĻ������������г�����ζ����A��B�ĺ��������֮�͵���F���������������ش��������⣺���û�ѧʽ����
��1��A��C��D��E����Ԫ��ԭ�Ӱ뾶�Ĵ�С��˳����____________����Ԫ�ط��ţ���
��2����A��E��F���γɵĹ����ͻ������У����ȶ�����ǿ������˳����_____��
��3��A��F�γɵĻ�������A��C�γɵĻ����ﷴӦ������Ļ�ѧʽΪ_______�������д��ڵĻ�ѧ������Ϊ_______��
��4��E��F����������ˮ�����������ǿ������˳����__________��
��5��C��E�⻯���۷е�Ĵ�С��ϵ��______��
��6��F�ĵ�����D������������ˮ���ﷴӦ�����ӷ���ʽΪ__________��
��7����BC��2��Ϊ��±�أ�������±�����ƣ�������ӣ�BC��2�ĵ���ʽΪ____________����������������Һ��Ӧ�Ļ�ѧ����ʽΪ_________________________________��
���𰸡� Na>P>N>H HCl>PH3 NH4Cl ���Ӽ������Լ� HClO4>H3PO4 NH3>PH3 Cl2+2OH-=Cl- +ClO-+H2O ![]() (CN)2+2NaOH=NaCN+NaCNO+H2O
(CN)2+2NaOH=NaCN+NaCNO+H2O
�����������ֶ�����Ԫ��A��B��C��D��E��F��ԭ��������������A��C�γɵĹ��ۻ�������ˮ�гʼ��ԣ��û�����ΪNH3����AΪHԪ�ء�CΪNԪ�أ�A��Dͬ�壬D��ԭ����������NԪ�أ���DΪNaԪ�أ�C��Eͬ�壬��EΪPԪ�أ�D��F�γɵĻ������������г�����ζ����������ΪNaCl����FΪClԪ�أ�A��B�ĺ��������֮�͵���F����������������BΪCԪ�ء�
��1��ͬ������������ԭ�Ӱ뾶��С��ͬ������ϵ���ԭ�Ӱ뾶��������A��C��D��E����Ԫ��ԭ�Ӱ뾶�Ĵ�С��˳����Na��P��N��H����2���ǽ�����Cl��P�������ȶ�����ǿ������˳����HCl��PH3����3��A��F�γɵĻ������Ȼ�����A��C�γɵĻ����ﰱ����Ӧ������Ļ�ѧʽΪNH4Cl�������д��ڵĻ�ѧ������Ϊ���Ӽ������Լ�����4���ǽ�����Cl��P����E��F����������ˮ�����������ǿ������˳����HClO4��H3PO4����5���������Ӽ���������C��E�⻯���۷е�Ĵ�С��ϵ��NH3��PH3����6��F�ĵ�����D������������ˮ���ﷴӦ�����ӷ���ʽΪCl2+2OH-=Cl- +ClO- +H2O����7����CN��2��Ϊ��±�أ�������±�����ƣ���������ӣ�CN��2�ĵ���ʽΪ![]() ����������������������Һ��Ӧ�ķ���ʽ��������������������Һ��Ӧ�Ļ�ѧ����ʽΪ(CN)2+2NaOH��NaCN+NaCNO+H2O��
����������������������Һ��Ӧ�ķ���ʽ��������������������Һ��Ӧ�Ļ�ѧ����ʽΪ(CN)2+2NaOH��NaCN+NaCNO+H2O��

 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�����Ŀ����֪A��g��+B��g��C��g��+D��s����Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
�¶ȡ� | 700 | 800 | 880 | 1000 | 1200 |
ƽ�ⳣ�� | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
�ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK= �� ��H0�������������=������
��2��800��ʱ����һ��5L���ܱ������г���0.4molA��0.7molB������Ӧ��ʼ2mim��A��ƽ����Ӧ����Ϊ0.01molL��1min��1 �� ��2minʱc��A��=molL��1 �� C�����ʵ���Ϊmol��������һ��ʱ���Ӧ�ﵽƽ��ʱ���������г���0.4molA�����ٴδﵽƽ���A�İٷֺ������һ��ƽ����������������С�������䡱��
��3������ѡ��������Ϊ�жϷ�Ӧ�ﵽƽ��������� a��ѹǿ����ʱ��ı�
b��v��A����v��b��=1��1
c����λʱ��������A��B�����ʵ������
d��C�İٷֺ������ֲ���
��4��880�� ʱ����Ӧ C��g��+D��s��A��g��+B��g����ƽ�ⳣ����ֵΪ ��
��5��ij�¶�ʱ��ƽ��Ũ�ȷ�����ʽ��c��A����c��B��=c��C������ô�ʱ���¶�Ϊ�森
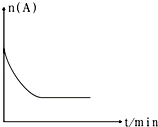
��6��ͼ��1000��ʱ������A�����ʵ����ı仯���ߣ�����ͼ�в������÷�Ӧ��1200��ʱA�����ʵ����ı仯����ͼ ��