题目内容
13.卡斯钠法制取金属钠的原理是:以氢氧化钠为原料,放入铁质容器中熔化,在稀有气体的保护下,以镍为阳极,铁为阴极,在阴极析出金属钠.写出反应的化学方程式为:4NaOH$\frac{\underline{\;电解\;}}{\;}$4Na+2H2O+O2↑.其中,氧化产物是:O2,若反应转移0.8mol电子,至少消耗32g NaOH.分析 电解熔融的氢氧化钠,钠离子在阴极得电子生成Na,氢氧根离子在阳极失电子生成氧气和水,根据反应物和生成物写出方程式,由化合价的变化以及氧化还原反应的概念判断.
解答 解:电解熔融的氢氧化钠,钠离子在阴极得电子生成Na,氢氧根离子在阳极失电子生成氧气和水,则电极方程式为:4NaOH$\frac{\underline{\;电解\;}}{\;}$4Na+2H2O+O2↑,O元素的化合价升高,则氧气为氧化产物,反应中4mol氢氧化钠转移4mol电子,则若反应转移0.8mol电子,消耗0.8molNaOH,其质量为m(NaOH)=nM=0.8mol×40g/mol=32g;
故答案为:4NaOH$\frac{\underline{\;电解\;}}{\;}$4Na+2H2O+O2↑;O2;32.
点评 本题考查了电解原理的应用、氧化还原反应的应用,题目难度不大,注意把握电解时阴阳两极发生的反应.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
4.合成结构简式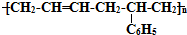 的高聚物,其单体是( )
的高聚物,其单体是( )
①苯乙烯 ②丁烯 ③1,3-丁二烯 ④丙炔 ⑤苯丙烯.
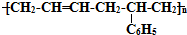 的高聚物,其单体是( )
的高聚物,其单体是( )①苯乙烯 ②丁烯 ③1,3-丁二烯 ④丙炔 ⑤苯丙烯.
| A. | ①② | B. | ④⑤ | C. | ③⑤ | D. | ①③ |
8.下列说法正确的是( )
| A. |  的名称为2-乙基丙烷 的名称为2-乙基丙烷 | |
| B. | CH2═CHCH3不能发生取代反应 | |
| C. | 新戊烷与Br2发生一取代生成两种有机物 | |
| D. | 2-甲基-1,3-丁二烯与等物质的量的Br2发生加成反应的产物有3种 |
18.当前,党的群众路线教育实践活动的主要任务是聚焦到作风建设上,集中解决形式主义、官僚主义、享乐主义和奢靡之风这“四风”问题,下列行为与该活动不符合的是( )
| A. | 分类回收、利用垃圾,减少资源浪费 | |
| B. | 推广使用一次性木筷,减少疾病传染 | |
| C. | 减少公车使用,从而减少化石燃料的使用 | |
| D. | 研究煤和石油脱硫技术,减少酸雨发生 |
5.下列各组离子在水溶液中能大量共存的是( )
| A. | Na+、Ba2+、Cl-、SO42- | B. | Ca2+、HCO3-、Cl-、K+ | ||
| C. | Mg2+、Ag+、NO3-、Cl- | D. | H+、Cl-、Na+、CO32- | ||
| E. | SO32-、Ba2+,H+,NO3- |
11.下列分子中,原子的最外层电子数均满足8电子稳定结构的是( )
| A. | NH3 | B. | SiCl4 | C. | BF3 | D. | PCl5 |
