题目内容
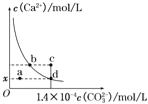
【题目】25℃时,用浓度均为0.1 mol·L-1的NaOH溶液和盐酸分别滴定体积均为20mL、浓度均为0.1 mol·L-1的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法中正确的是
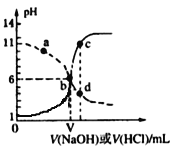
A. HA为弱酸,BOH为强碱
B. a点时,溶液中粒子浓度存在关系:c(B+) > c(Cl-) > c(OH-) > c(BOH)
C. c、d两点溶液混合后微粒之间存在关系:c(H+) = c(OH-) + c(BOH)
D. b点时两种溶液中水的电离程度相同,且V=20
【答案】C
【解析】根据图象分析,虚线图象是HCl滴定BOH溶液,实线图象是NaOH滴定HA溶液,HA溶液与BOH溶液均为0.1 mol·L-1,根据起始状态判断,HA溶液的pH为1,则HA完全电离,是强酸;BOH起始时溶液的pH为11,不完全电离,则BOH是弱碱; HA是强酸,BOH是弱碱,A错误;a点所在曲线是![]() 的HCl滴定
的HCl滴定![]() 的BOH,根据溶液中的电荷守恒:
的BOH,根据溶液中的电荷守恒:![]() ,溶液为碱性,大量存在BOH,溶液中
,溶液为碱性,大量存在BOH,溶液中![]() ,则
,则![]() ,反应产物为BCl且剩余大量的BOH,溶液中
,反应产物为BCl且剩余大量的BOH,溶液中![]() ,B错误;c点对于NaOH滴定HA溶液时,溶液此时为碱性,可判断此时溶液的组分为NaOH过量和NaA;d点对于HCl滴定BOH溶液时,溶液此时为酸性,可判断溶液的组分为BCl和过量的HCl,因为c、d点时滴加NaOH或者HCl的量相同,则在c、d点时,平衡时NaOH和NaA,BCl和HCl的物料比相同,记为
,B错误;c点对于NaOH滴定HA溶液时,溶液此时为碱性,可判断此时溶液的组分为NaOH过量和NaA;d点对于HCl滴定BOH溶液时,溶液此时为酸性,可判断溶液的组分为BCl和过量的HCl,因为c、d点时滴加NaOH或者HCl的量相同,则在c、d点时,平衡时NaOH和NaA,BCl和HCl的物料比相同,记为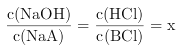 ,根据反应关系和初始条件关系,可以知道c、d点溶液混合之后发生反应,最终溶液的组分关系为x份
,根据反应关系和初始条件关系,可以知道c、d点溶液混合之后发生反应,最终溶液的组分关系为x份![]() 、1份
、1份![]() 和1份
和1份![]() ,根据电荷守恒,c(Na+)+c(H+)+c(B+)=c(OH-)+c(A-)+c(Cl-),根据物料守恒: c(A-)= c(B+)+ c(BOH),由于c(Na+)= c(Cl-),则有c(H+) = c(OH-) + c(BOH);D正确;正确选项C。
,根据电荷守恒,c(Na+)+c(H+)+c(B+)=c(OH-)+c(A-)+c(Cl-),根据物料守恒: c(A-)= c(B+)+ c(BOH),由于c(Na+)= c(Cl-),则有c(H+) = c(OH-) + c(BOH);D正确;正确选项C。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,则定蛋壳中钙含量操作步骤如图12所示:
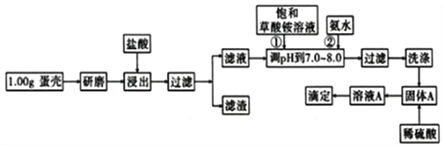
已知:CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是____________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是__________________。
(3)洗涤最好选用_____(填“冰水”或“0.1mol/L草酸铵溶液”),其目的是____________。
(4))滴定操是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸台定量关系,可间接求出钙的含量
步骤1:将溶液A加蒸馏水稀释至250mL。
步骤2:取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化
步骤3:用00190mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1mL.
步骤4:重复步骤2、步骤3的操作3次,记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4溶液滴入的体积(mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2=20.00 |
3 | 0.0190 | V2=19.98 |
4 | 0.0190 | V4=20.80 |
①KMnO4溶液和草酸溶液在稀硫酸中反应的离子方程式为_______________________。
②滴定终点的现象是_________________。
③该蛋壳中CaCO3的质量分数=_______%,则此法求得的钙含量_____实际值(填“>”“=”或“<”)