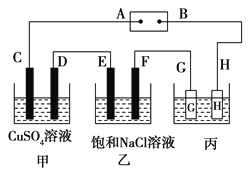
题目内容
【题目】某纯碱样品中含有少量NaCl杂质,现用如图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去;碱石灰是生石灰与氢氧化钠的混合物,可以吸收水和二氧化碳)。
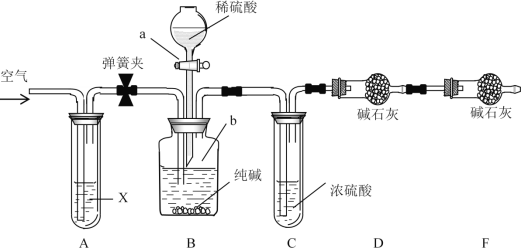
实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为80.20g;
③准确称得20.00g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入一定量空气;
⑥然后称得干燥管D的总质量为86.36g ;
⑦重复步骤⑤和⑥的操作,直到干燥管D的质量不变,为86.80 g。
试回答:
(1)装置B中发生反应的离子方程式_________________________________;
(2)装置A中试剂X应选用足量的(______)
A.饱和NaCl溶液 B.浓H2SO4
C.NaHCO3溶液 D.NaOH溶液
(3)①请用文字叙述装置C的作用:__________________________________。
②请用文字叙述装置E的作用:__________________________________。
(4)如果将分液漏斗中的硫酸换成浓度相同的盐酸,则会导致测定结果_____(填“偏大”、 “偏小”或“不变”,下同);若没有操作⑤⑦,则会导致测定结果__________。
(5)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为_________。
【答案】2H++CO32- = H2O+CO2↑ (2) 吸收CO2气体中的水蒸气,避免测量结果产生误差(偏大) 防止空气中的水或CO2进入D引起测量误差(偏大) 偏大 偏小 79.5%
【解析】
B中发生发反应:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,C中浓硫酸干燥二氧化碳,D中碱石灰增重为生成二氧化碳的质量,进而计算样品中碳酸钠的质量分数。通入空气排尽装置中二氧化碳,使二氧化碳进入D中完全吸收,空气中的二氧化碳会影响实验,A中盛放浓氢氧化钠溶液可以除去空气中二氧化碳。F装置吸收空气中的二氧化碳、水蒸气,防止加入D中影响二氧化碳质量测定。
(1)在装置B中,硫酸与碳酸钠发生复分解反应,产生硫酸钠、二氧化碳和水,发生反应的离子方程式是2H++CO32- =H2O+CO2↑;
(2)鼓入空气可以将装置内残留的二氧化碳全部排出进入D装置,达到精确测量的目的;装置A中试剂X可以除去空气中的二氧化碳,防止干扰物质含量的测定,达到精确测量的目的,应选用浓NOH溶液,选项D合理;
(3)①B中生成二氧化碳中混有水蒸气,若没有C装置中盛有的浓硫酸来吸收,D中碱石灰就吸收二氧化碳与水蒸气,导致测定二氧化碳的质量偏大,样品中碳酸钠的质量分数会偏大;
②装置E盛有碱石灰,可以吸收空气中的二氧化碳和水蒸气,防止空气中的水或CO2进入D引起测量误差(偏大);
(4)如果将分液漏斗中的硫酸换成浓度相同的盐酸,由于HCl具有挥发性,它会与碱石灰发生反应,导致测定结果偏大;若没有操作⑤⑦,碳酸钠反应产生的部分二氧化碳气体会在装置中滞留,使测定结果偏小;
(5)生成二氧化碳的质量为m(CO2)=86.80 g-80.20g=6.60g,其物质的量为n(CO2)=6.60g÷44g/mol=0.15mol,根据碳原子守恒可知样品中碳酸钠的质量为m(Na2CO3)=0.15mol×106g/mol=15.9g,则纯碱样品Na2CO3的质量分数为:(15.9g÷20.00g) ×100%=79.5%。