题目内容
【题目】己知:I2+2S2O32-=S4O62-+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×l0-39 | 1.7×l0-7 | 1.3×l0-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuC12·2H2O晶体,常加入CuO或Cu(OH)2,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________。 过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuC12, 原因是(用化学方程式表示)_____________________________,由CuCl2·2H2O晶体得到纯净的无水CuCl2的合理方法是________________________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取1.44g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(CuI)。将反应后的溶液稀释为100 mL,用0.1000mol/LNa2S2O3标准溶液(溶液呈弱碱性)进行滴定,滴定结果如下表所示。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.02 | 22.03 |
2 | 25.00 | 2.00 | 21.98 |
3 | 25.00 | 0.20 | 20.22 |
①可选用__________作滴定指示剂,滴定终点的现象是_________________________。
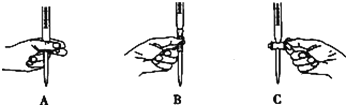
②滴定过程中操作滴定管的图示正确的是_____________。
③若滴定时出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶 b.滴定前滴定管尖嘴有气泡,滴定后气泡消失
c.酸式滴定管滴至终点时俯视读数 d.酸式滴定管用蒸水洗后,未用标准液润洗
④CuCl2溶液与KI反应的离子方程式为______________________________。
⑤该试样中CuCl2·2H2O的质量百分数为____________________。
【答案】 2.6×10-9mol/L CuCl2+2H2O![]() Cu(OH)2+2HCl 在干燥氯化氢气流中加热 淀粉 滴入最后一滴标准液,溶液由蓝色变为无色且半分钟内不复原 B bd 2Cu2++4I-=2CuI↓+I2 95%
Cu(OH)2+2HCl 在干燥氯化氢气流中加热 淀粉 滴入最后一滴标准液,溶液由蓝色变为无色且半分钟内不复原 B bd 2Cu2++4I-=2CuI↓+I2 95%
【解析】(1)调至pH=4,c(H+)=10-4 mol/L, c(OH-)=10-10 mol/L, 根据公式Ksp= c(Fe3+)c3(OH-);c(Fe3+)×10-30=2.6×l0-39, c(Fe3+)= 2.6×10-9mol/L;正确答案:2.6×10-9mol/L;
(2)CuCl2的水溶液能够发生水解反应,生成少量的Cu(OH)2;正确答案为:CuCl2+2H2O![]() Cu(OH)2+2HCl;只有在不断通入氯化氢气流的情况下,抑制氯化铜的水解,才可以在直接加热情况下得到纯净的无水CuCl2;
Cu(OH)2+2HCl;只有在不断通入氯化氢气流的情况下,抑制氯化铜的水解,才可以在直接加热情况下得到纯净的无水CuCl2;
(3)①CuCl2氧化I-生成I2;然后用Na2S2O3标准溶液进行滴定含有碘单质的溶液,而淀粉溶液遇碘单质显蓝色,可以用淀粉做指示剂,达到滴定终点时,溶液由蓝色变成无色,且半分钟内溶液不恢复原来的颜色;正确答案:淀粉;滴入最后一滴标准液,溶液由蓝色变为无色且半分钟内不复原;
②Na2S2O3标准溶液显弱碱性,要用碱式滴定管进行盛装,答案选B。
③a.滴定前用蒸馏水冲洗锥形瓶,不影响溶液溶质的量,测定结果无影响,a错误; b.滴定前滴定管尖嘴有气泡,滴定后气泡消失,造成滴定管内液体的读数增大,相当于消耗滴定液的体积增大,结果偏高,b正确;c.酸式滴定管滴至终点时俯视读数,所量液体的体积偏小,结果偏低,c错误;d.酸式滴定管用蒸馏水洗后,未用标准液润洗,造成标准液的浓度变小,消耗的体积增大,结果偏高;d正确;正确选项:bd;
④CuCl2溶液与KI反应中,铜由+2价降低到+1价,生成CuI;-1价的碘升高到0价,生成单质碘;正确答案:2Cu2++4I-=2CuI↓+I2;
⑤根据图表可看出,消耗Na2S2O3标准溶液的体积分别为:22.01 mL、 19.98 mL、20.02 mL;第一组误差较大,用第二组和第三组数据求出消耗0.1000mol/LNa2S2O3标准溶液平均为20 mL; CuCl2与KI发生反应: 2Cu2++4I-=2CuI↓+I2;Na2S2O3滴定I2反应:2S2O32- + I2 =S4O62-+2I-;由上述反应关系可得:2Cu2+~I2~2 S2O32-,则有:n(S2O32-)=0.1000×20.00×10-3=2×10-3 mol,n(Cu2+)= 2×10-3 mol,n(CuCl2·2H2O)=n(Cu2+)= 2×10-3 mol, m(CuCl2·2H2O)= 2×10-3×171=0.342 g。试样中CuCl2·2H2O的质量分数为0.324÷0.36×100%=95%;正确答案为95%;

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案【题目】阿司匹林(乙酰水杨酸,![]() )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:

制备基本操作流程如下:
![]()
主要试剂和产品的物理常数如下表所示:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 易水解 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是________________________________。
(2)合成阿司匹林时,最合适的加热方法是______________________。

(3)提纯粗产品流程如下,加热回流装置如图:
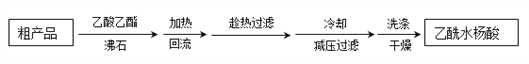
①沸石的作用是__________________________________;
②冷凝水的流出方向是________________(填“b”或“c”);
③使用温度计的目的是_____________________________________________________。
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(![]() ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为__________________(用百分数表示,小数点后一位)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为__________________(用百分数表示,小数点后一位)。
【题目】砷(As)可作为半导体村料锗(Ge)和硅的掺杂元素,这些材料广泛应用于发光二极管、红外线发射器等。回答下列问题:
(1)天然的SiO2存在形态有结晶形和无定形两大类,结晶形SiO2能自发的呈现规则多面体外形的性质被称为晶体的______________性,区分这两种形态的SiO2最可靠的方法足对固体进行___________实验。
(2)基态砷原子的价层电子排布图为_____________,最高能层符号为_____________,Ge、As、Se第一电离能从大到小的顺序为_____________________。
(3)锗元素与碳元素类似,可形成锗烷(GenH2n+2),但至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因_____________________。
化学键 | C-C | C-H | Ge-Ge | Ge-H |
键能(kJ·mol-1) | 346 | 411 | 188 | 288 |
(4) GeCl4分子中的键角为_____________,GeH4分子中Ge的_____________轨道和H的_________轨道重叠形成σ键。
(5)立方砷化镓的晶胞如下图所示,已知晶胞边长为565pm,则Ga-As键的键长为___________pm(只列出算式即可),Ga-As键中共用电子对偏向____________(填“Ga”或“As”)。