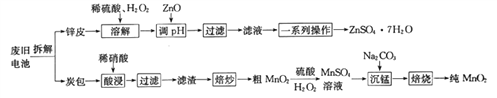
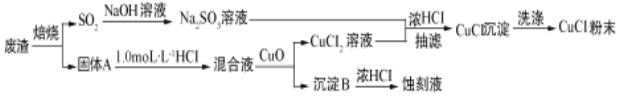
题目内容
【题目】砷(As)可作为半导体村料锗(Ge)和硅的掺杂元素,这些材料广泛应用于发光二极管、红外线发射器等。回答下列问题:
(1)天然的SiO2存在形态有结晶形和无定形两大类,结晶形SiO2能自发的呈现规则多面体外形的性质被称为晶体的______________性,区分这两种形态的SiO2最可靠的方法足对固体进行___________实验。
(2)基态砷原子的价层电子排布图为_____________,最高能层符号为_____________,Ge、As、Se第一电离能从大到小的顺序为_____________________。
(3)锗元素与碳元素类似,可形成锗烷(GenH2n+2),但至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因_____________________。
化学键 | C-C | C-H | Ge-Ge | Ge-H |
键能(kJ·mol-1) | 346 | 411 | 188 | 288 |
(4) GeCl4分子中的键角为_____________,GeH4分子中Ge的_____________轨道和H的_________轨道重叠形成σ键。
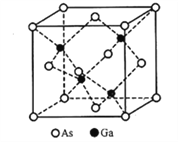
(5)立方砷化镓的晶胞如下图所示,已知晶胞边长为565pm,则Ga-As键的键长为___________pm(只列出算式即可),Ga-As键中共用电子对偏向____________(填“Ga”或“As”)。
【答案】 自范 X-射线衍射 ![]() N As>Se>Ge 锗烷中“Ge-Ge”键和“Ge-H”键键能较小,易断裂,导致长链锗烷难以形成( 109028' sP3杂化 1s
N As>Se>Ge 锗烷中“Ge-Ge”键和“Ge-H”键键能较小,易断裂,导致长链锗烷难以形成( 109028' sP3杂化 1s ![]() ×565 As
×565 As
【解析】试题分析:试题以半导体材料为载体,主要考查晶体的自范性、晶体与非晶体区分方法、电子排布、第一电离能、键能与分子稳定性关系、杂化、σ键形成、电负性、晶体的简单计算等知识,考查考生对物质结构知识的综合运用能力和晶体的简单计算能力。
解析:(1)晶体能自发呈现规则多面体外形的性质称作晶体的自范性。区分晶体与非晶体的最可靠的方法是X-射线衍射。正确答案:自范、X-射线衍射。(2)砷为33号元素,核外电子排布式为1s22s22p63s23p63d104s24p3,价电子排布为4s24p3,所以价电子排布图为![]() ,最高能层为第四层,能层符号是N,As位于元素周期表第四周期ⅤA,Ge为32号元素,位于元素周期表第四周期ⅣA,Se为34号元素,位于元素周期表第四周期ⅥA,同一周期从左到右各元素第一电离能呈增大的趋势,但是处于全满和半满是一种亚稳定状态,第一电离能比相邻的元素高,所以它们的第一电离能大小顺序为As>Se>Ge。正确答案:
,最高能层为第四层,能层符号是N,As位于元素周期表第四周期ⅤA,Ge为32号元素,位于元素周期表第四周期ⅣA,Se为34号元素,位于元素周期表第四周期ⅥA,同一周期从左到右各元素第一电离能呈增大的趋势,但是处于全满和半满是一种亚稳定状态,第一电离能比相邻的元素高,所以它们的第一电离能大小顺序为As>Se>Ge。正确答案:![]() 、N、As>Se>Ge。(3)由表格数据可知,C—C键的键能远大于Ge—Ge键,C—H键的键能远大于Ge—H键,因此锗烷中Ge—Ge键、Ge—H键都容易发生断裂。正确答案:锗烷中Ge-Ge键和Ge-H键键能较小,易断裂,导致长链锗烷难以形成。(4)GeCl4、GeH4分子中心原子Ge都是采用sp3杂化,所以GeCl4分子中键角为109028'。GeH4分子中,Ge原子使用sp3杂化轨道分别与H原子的1s轨道重叠形成σ键。正确答案:109028'、sp3杂化、1s。(5)立方砷化镓晶胞中,As位于立方体的顶点和面心的位置,Ga位于立方体对角线距离顶点1/4处,立方体对角线长
、N、As>Se>Ge。(3)由表格数据可知,C—C键的键能远大于Ge—Ge键,C—H键的键能远大于Ge—H键,因此锗烷中Ge—Ge键、Ge—H键都容易发生断裂。正确答案:锗烷中Ge-Ge键和Ge-H键键能较小,易断裂,导致长链锗烷难以形成。(4)GeCl4、GeH4分子中心原子Ge都是采用sp3杂化,所以GeCl4分子中键角为109028'。GeH4分子中,Ge原子使用sp3杂化轨道分别与H原子的1s轨道重叠形成σ键。正确答案:109028'、sp3杂化、1s。(5)立方砷化镓晶胞中,As位于立方体的顶点和面心的位置,Ga位于立方体对角线距离顶点1/4处,立方体对角线长![]() ,则Ga—As键键长
,则Ga—As键键长![]() 。Ga和As同处于第四周期,原子序数相对较小的Ga位于左侧,电负性较小,所以Ga—As键中共用电子对偏向电负性较大大As。正确答案:
。Ga和As同处于第四周期,原子序数相对较小的Ga位于左侧,电负性较小,所以Ga—As键中共用电子对偏向电负性较大大As。正确答案:![]() 、As。
、As。

【题目】己知:I2+2S2O32-=S4O62-+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×l0-39 | 1.7×l0-7 | 1.3×l0-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuC12·2H2O晶体,常加入CuO或Cu(OH)2,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________。 过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuC12, 原因是(用化学方程式表示)_____________________________,由CuCl2·2H2O晶体得到纯净的无水CuCl2的合理方法是________________________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取1.44g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(CuI)。将反应后的溶液稀释为100 mL,用0.1000mol/LNa2S2O3标准溶液(溶液呈弱碱性)进行滴定,滴定结果如下表所示。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.02 | 22.03 |
2 | 25.00 | 2.00 | 21.98 |
3 | 25.00 | 0.20 | 20.22 |
①可选用__________作滴定指示剂,滴定终点的现象是_________________________。
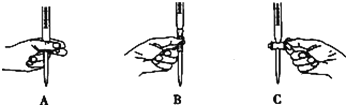
②滴定过程中操作滴定管的图示正确的是_____________。
③若滴定时出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶 b.滴定前滴定管尖嘴有气泡,滴定后气泡消失
c.酸式滴定管滴至终点时俯视读数 d.酸式滴定管用蒸水洗后,未用标准液润洗
④CuCl2溶液与KI反应的离子方程式为______________________________。
⑤该试样中CuCl2·2H2O的质量百分数为____________________。