题目内容
6.0.1mol•L-1NaOH25.00mL与0.2000mol•L-1HCl溶液多少毫升才能恰好完全反应?分析 NaOH和HCl发生反应NaOH+HCl=NaCl+H2O,如二者恰好中和,应满足n(NaOH)=n(HCl),结合n=cV计算该题.
解答 解:n(NaOH)=0.1mol/L×0.025L=0.0025mol,与HCl发生NaOH+HCl=NaCl+H2O,如二者恰好中和,应满足n(NaOH)=n(HCl),
则V(HCl)=$\frac{0.0025mol}{0.2mol/L}$=0.0125L=12.500mL,
答:0.1mol•L-1NaOH25.00mL与0.2000mol•L-1HCl溶液12.500毫升才能恰好完全反应.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握反应的化学方程式以及相关计算公式的运用,难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
17.下列装置或操作不正确的是( )
| A. | 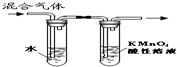 装置可用于检验溴乙烷消去反应的产物 | |
| B. |  装置可用于放出碘的四氯化碳溶液 | |
| C. | 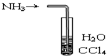 装置可用于吸收NH3防止倒吸 | |
| D. | 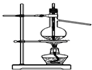 装置可用于实验室制备蒸馏水 |
14.某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究.

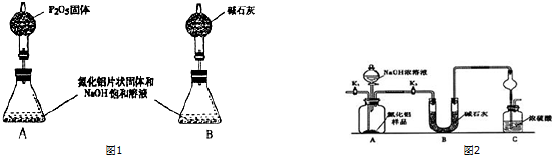
(1)装置A中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置B的作用是防止C中液体倒吸入A中(或防倒吸,或安全瓶).
(2)设计装置D的目的是验证SO2的还原性,E中NaOH全部转化为NaHSO3的标志是溶液红色褪去.
(3)装置C的作用是贮存多余的气体,C中应放置的液体是饱和NaHSO3溶液.
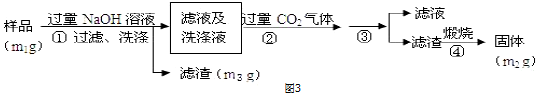
(4)反应结束时烧瓶中Cu有剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量.经冷却,定量稀释后进行下列实验,能达到目的是b c(填序号);
a.用酸碱中和滴定法测定 b.与足量Zn反应,测量生成H2的体积
c.用PH计测溶液PH值 d.与足量BaCl2溶液反应,称量生成沉淀的质量
(5)向E瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
(6)请设计简单实验证明室温下HSO3-的电离平衡常数Ka与水解平衡常教Kb的相对大小常温下,用pH试纸(或pH计)测定NaHS03溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb.

(1)装置A中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置B的作用是防止C中液体倒吸入A中(或防倒吸,或安全瓶).
(2)设计装置D的目的是验证SO2的还原性,E中NaOH全部转化为NaHSO3的标志是溶液红色褪去.
(3)装置C的作用是贮存多余的气体,C中应放置的液体是饱和NaHSO3溶液.
(4)反应结束时烧瓶中Cu有剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量.经冷却,定量稀释后进行下列实验,能达到目的是b c(填序号);
a.用酸碱中和滴定法测定 b.与足量Zn反应,测量生成H2的体积
c.用PH计测溶液PH值 d.与足量BaCl2溶液反应,称量生成沉淀的质量
(5)向E瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
| ② | 滴加少量棕红色的KI3溶液,振荡 | II | |
| ③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
1.化学与生产、生活、社会密切相关,下列说法不正确的是( )
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 | |
| B. | 工业用石灰石、纯碱和石英在高温下制得玻璃的原理与硅酸和碳酸的酸性强弱无关 | |
| C. | 以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
18.下列各组中的固体物质,只需加水就可以鉴别的一组是( )
| A. | CaCO3、BaSO4、Na2CO3 | B. | CuSO4、NaCl、NaCO3 | ||
| C. | NaCl、CuSO4、CaCO3 | D. | NaCl、KNO3、BaCl2 |
8.只含有一种元素的物质( )
| A. | 一定是一种单质 | B. | 可能是化合物 | ||
| C. | 一定是纯净物 | D. | 可能是纯净物,也可能是混合物 |