题目内容
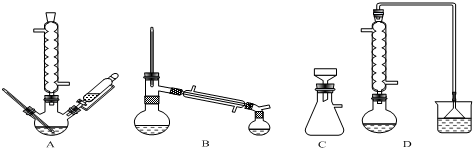
17.下列装置或操作不正确的是( )| A. | 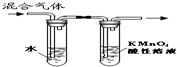 装置可用于检验溴乙烷消去反应的产物 | |
| B. | 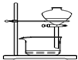 装置可用于放出碘的四氯化碳溶液 | |
| C. | 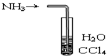 装置可用于吸收NH3防止倒吸 | |
| D. | 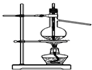 装置可用于实验室制备蒸馏水 |
分析 A.溴乙烷的消去产物为乙烯,能被高锰酸钾氧化;
B.碘的四氯化碳溶液密度大于酸溶液,分层后在混合液下层;
C.四氯化碳的密度比水的大,能防止氨气倒吸;
D.制取蒸馏水不需要温度计,且缺少冷凝管.
解答 解:A.溴乙烷的消去产物为乙烯,能被高锰酸钾氧化,则利用高锰酸钾溶液褪色可检验乙烯,故A正确;
B.碘的四氯化碳溶液在下层,可从分液漏斗的下端放出,故B正确;
C.四氯化碳的密度比水的大,与水分层,该装置能防止氨气倒吸,故C正确;
D.装置中温度计的水银球位置错误,应该放在蒸馏烧瓶的支管口处,实验室制取蒸馏水可以不用温度计,且还需要冷凝管,故D错误;
故选D.
点评 本题考查实验方案的评价,熟悉混合物的分离、物质的性质即可解答,选项C为解答的难点和易错点,题目难度不大,试题有利于提高学生的分析能力及化学实验能力.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
相关题目
7.下列离子方程式书写正确的是( )
| A. | 向次氯酸钙溶液通过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+CO32-+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+=3I2+3H2O | |
| D. | 氢氧化钡溶液中加入硫酸:Ba2++OH-+H++SO42-═BaSO4+H2O |
5.下列物质按1﹕1反应的离子方程式正确的是( )
| A. | 二氧化碳与石灰水:CO2+OH-=HCO3- | |
| B. | 氯化铁和硫氢化钠:2Fe3++2HS-=Fe2++2H++FeS↓+S↓ | |
| C. | 硫酸亚铁铵和氢氧化钡:2NH4++2OH-+Ba2++SO42-=2NH3•H2O+BaSO4↓ | |
| D. | 在酸性条件下亚硫酸钠和硫化钠:2SO32-+2S2-+8H+=3S↓+SO2↑+4H2O |
12.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,18g14CH4所含中子数目为12NA | |
| B. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA | |
| C. | 常温常压下,1mol NaHCO3与足量稀硫酸反应,生成气体的体积大于22.4L | |
| D. | 1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为8NA |
19.高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,工业上用w kg难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),共制备高纯六水氯化锶晶体(a kg)的过程为:
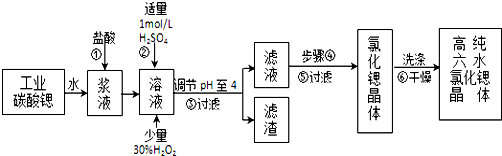
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
(1)操作①加快反应速率的措施有加热或充分搅拌或适当增加盐酸浓度等 (写一种).操作①中盐酸能否改用硫酸,其理由是:不能,否则会大量生成硫酸锶的沉淀,减少产物生成.
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B.
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B.
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.

已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B.
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B.
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.