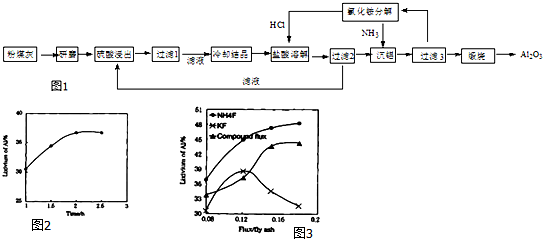
题目内容
7.氮化铝(AlN)是一种新型无机非金属材料.工业上制备原理如下:Al2O3+N2+3C═2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为3:2.AlN 产品中常含有碳等不与NaOH 溶液反应的杂质,为了分析某AlN 样品中AlN 的含量,某实验小
组设计了如下三种实验方案.已知:AlN+NaOH+H2O=NaAlO2+NH3↑
[方案1]有人想用下列图1A、B 两个装置中的一种(在通风橱内进行),只需进行简单而又必要的
数据测定,用差量法就可测定样品中AlN 的质量分数,较合理的装置是:B(填代号).
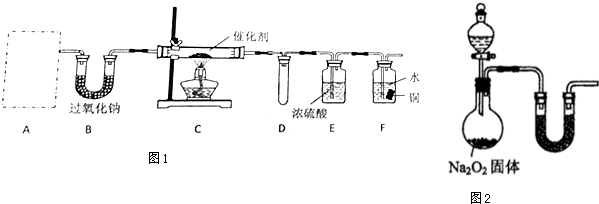
[方案2]取一定量(m1)的样品,用以下装置测定样品中AlN 的纯度(夹持装置已略去).
如图2C 装置中球形干燥管的作用是防止倒吸.
完成以下实验步骤:组装好实验装置,首先检查装置气密性;再加入实验药品,接下来关闭K1,打
开K2,打开分液漏斗活塞,加入NaOH 浓溶液,至不再产生气体.打开K1,通入氮气一段时间.
请回答:I、需测定(填A、B、C)装置反应前后的质量变化.II、通入氮气的目的是把装置中残留的氨气全部赶入C装置.
[方案3]按以下步骤测定样品中A1N 的含量:
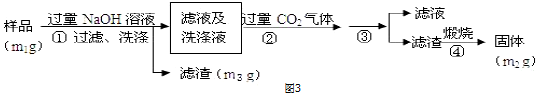
(1)步骤②生成沉淀的离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓.
(2)步骤③的操作是过滤、洗涤.A1N 的纯度是$\frac{41{m}_{2}}{51{m}_{1}}$×100%(用m1、m2表示).
分析 依据氧化还原反应的特征颜色化合价变化分析判断,颜色化合价升高做还原剂被氧化得到氧化产物,元素化合价降低做氧化剂被还原生成还原产物;
[方案1]根据图可知,由于五氧化二磷能吸收氨气和水蒸汽等,所以图2B中装置的质量在反应前后没有变化,A中反应产生的氨气挥发,产生氨气的质量就是整个装置的质量变化,所以可以测量得氨气 的质量,根据氨气的质量计算出氮化铝的质量,进而可以确定AlN样品的纯度,据此答题;
[方案2]分析装置和仪器作用分析,氨气是和浓硫酸能发生反应的气体,易发生倒吸,仪器作用是防止倒吸的作用;
组装好实验装置,依据原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
[方案3]流程分析可知,样品溶解于过量的氢氧化钠溶液中过滤洗涤,得到滤液和洗涤液中通入过量二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,过滤洗涤得到氢氧化铝固体,煅烧得到氧化铝固体为m2g;
(1)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成氢氧化铝沉淀和碳酸氢钠;
(2)上述分析可知步骤③是过滤洗涤得到氢氧化铝沉淀,测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量.
解答 解:氮化铝(AlN)制备:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO,反应中氮元素化合价从0价变化为-3价,做氧化剂被还原为AlN,碳元素化合价从0价变化为+2价,做还原剂被氧化为一氧化碳,所以氧化产物与还原产物的物质的量之比为3:2,
故答案为:3:2;
[方案1]根据图可知,由于五氧化二磷能吸收氨气和水蒸汽等,所以图1中A中装置的质量在反应前后没有变化,B中反应产生的氨气挥发,产生氨气的质量就是整个装置的质量变化,所以可以测量得氨气的质量,根据氨气的质量计算出氮化铝的质量,进而可以确定AlN样品的纯度,图1中B装置合理,
故答案为:B;
[方案2]氨气是与浓硫酸能发生反应的气体,易发生倒吸,图C装置中球形干燥管的作用是防止倒吸的作用,
故答案为:防止倒吸;
组装好实验装置,气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,
故答案为:C;把装置中残留的氨气全部赶入C装置;
[方案3]流程分析可知,样品解于过量的氢氧化钠溶液中过滤洗涤,得到滤液和洗涤液中通入过量二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,过滤洗涤得到氢氧化铝固体,煅烧得到氧化铝固体为m2g,
(1)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(2)上述分析可知步骤③是过滤洗涤得到氢氧化铝沉淀,测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量,Al2O3物质的量=$\frac{{m}_{2}g}{102g/mol}$=$\frac{{m}_{2}}{102}$mol,依据铝元素守恒得到样品中氮元素物质的量=n(AlN)=$\frac{{m}_{2}}{102}$mol×2=$\frac{{m}_{2}}{51}$mol,A1N的纯度=$\frac{\frac{{m}_{2}}{51}×41}{{m}_{1}}$×100%=$\frac{41{m}_{2}}{51{m}_{1}}$×100%,
故答案为:过滤、洗涤;$\frac{41{m}_{2}}{51{m}_{1}}$×100%.
点评 本题考查了物质组成的实验探究、实验基本操作、物质组成的计算应用,注意过程的理解应用,掌握基础是解题关键,题目难度中等.

| A. | 二氧化碳与石灰水:CO2+OH-=HCO3- | |
| B. | 氯化铁和硫氢化钠:2Fe3++2HS-=Fe2++2H++FeS↓+S↓ | |
| C. | 硫酸亚铁铵和氢氧化钡:2NH4++2OH-+Ba2++SO42-=2NH3•H2O+BaSO4↓ | |
| D. | 在酸性条件下亚硫酸钠和硫化钠:2SO32-+2S2-+8H+=3S↓+SO2↑+4H2O |
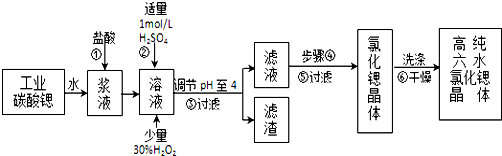
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B.
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B.
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.