题目内容
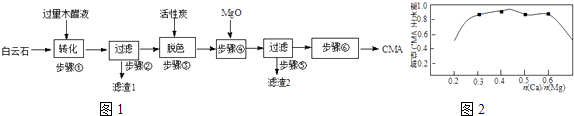
【题目】实验室制备氯化亚铜(一种难溶于水的白色固体)的流程如下:

(1)“反应I”在加热条件下进行,同时有MnCl2生成,该反应的化学方程式为 __。
(2) “反应Ⅱ”中杂质与Cl2反应的化学方程式为__。 ⑶实验所用SO2气体可由铜和浓硫酸反应制得,该反应的化学方程式为__。
(4)“反应Ⅲ”的离子方程式为___。
(5)若将等物质的量的S02、Cl2通入水中,所得溶液几乎没有漂白性,该反应的离子方程式为___。
【答案】 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 2Fe+3Cl2
MnCl2+Cl2↑+2H2O 2Fe+3Cl2![]() 2FeCl3 Cu+2H2SO4 (浓)
2FeCl3 Cu+2H2SO4 (浓) ![]() CuSO4+SO2↑+2H2O SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO
CuSO4+SO2↑+2H2O SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO![]() +4H+ Cl2+SO2+2H2O=4H++SO
+4H+ Cl2+SO2+2H2O=4H++SO![]() +2Cl-
+2Cl-
【解析】(1)MnO2与浓盐酸反应生成MnCl2和Cl2,Mn元素化合价由+4价降低为+2价,盐酸中Cl元素化合价降为0价,根据元素守恒,反应有水生成,可得MnO2+HCl(浓) —MnCl2+Cl2↑+H2O,根据化合价升降守恒配平方程式:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)粗铜中含有少量铁,通入Cl2,将Cu氧化为CuCl2,将Fe氧化为FeCl3,生成FeCl3的反应方程式为2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(3)铜和浓硫酸反应制SO2,反应方程式为Cu+2H2SO4 (浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)将CuCl2、FeCl3固体溶解后,再将铁离子转化为红褐色的氢氧化铁沉淀,过滤除铁,得到溶液CuCl2。向溶液中通入SO2,生成目标产物CuCl,Cu元素化合价降低,被还原,则SO2被氧化为SO42-,离子方程式为SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(5)若将等物质的量的SO2、Cl2通入水中,恰好完全反应生成硫酸和盐酸,所得溶液没有漂白性,离子方程式为Cl2+SO2+2H2O=4H++SO42-+2Cl-。
【题型】综合题
【结束】
23
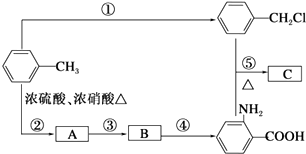
【题目】有关物质的转化关系如下图所示(反应中部分物质已略去)。A、C、G、K、M 为单质,其中G、K、L、M 为气体,其中M能使带火星的木条复燃,D可用作耐高温材料,为黑色磁性氧化物, E为常见的强碱。

(1)D的化学式为__。
(2)写出反应①的离子方程式:__。
(3)写出反应②的离子方程式:__。
(4)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:__。
【答案】 Al2O3 2Al+2OH—+2H2O=2AlO![]() +3H2↑ 2Fe2++Cl2=2Fe3++2Cl-
+3H2↑ 2Fe2++Cl2=2Fe3++2Cl- ![]()
【解析】M为气体单质,且M能使带火星的木条复燃,则M为O2;D可作耐高温材料,则D可能为高熔点的Al2O3或MgO;B为黑色磁性氧化物,则B为Fe3O4。“A+B→C+D”,A、C为单质,B、D为金属氧化物,则该反应为高温条件下金属间的置换反应,则A、C为金属单质,B为Fe3O4,可知C为Fe;E为强碱,A为金属单质,A与E反应生成气体单质G,所以A为两性金属Al,D为Al2O3,G为H2。“G+K→L”,G为H2,K为气体单质,L+B(Fe3O4)→F+H,又“F+E(强碱)→I”,则可推测F中含有铁的阳离子,与强碱反应生成沉淀;逆推L应为酸,两种单质化合得到的酸,则K为Cl2,L为HCl;Fe3O4溶于盐酸生成FeCl2和FeCl3;根据F+K(Cl2)→H,可得F为FeCl2,H为FeCl3;沉淀I+M(O2)→J,则沉淀I为Fe(OH)2,J为Fe(OH)3。
(1)根据上述分析,D为Al2O3;
(2)反应①为Al与强碱反应生成AlO2-和H2,离子方程式为2Al+2OH—+2H2O=2AlO2-+3H2↑;
(3)反应②为FeCl2+ Cl2→FeCl3,离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(4)反应③为Fe(OH)2被氧气氧化为Fe(OH)3,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;其中4mol Fe(OH)2失去4mol电子,氧气得电子,故单线桥可表示为:![]() 。
。