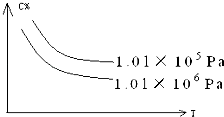题目内容
【题目】对于可逆反应:2A(g)+B(g)2C(g)△H<0,下列各图中正确的是( )
A.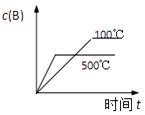
B.
C.
D.
【答案】C
【解析】解:A.该反应为放热反应,降低温度平衡正向移动,则低温下c(B)小,与图象不符,故A错误; B.增大压强,正逆反应速率均增大,且正反应速率大于逆反应速率,与图象不符,故B错误;
C.相同压强下,升高温度平衡逆向移动,n(C)减小;相同温度下增大压强平衡正向移动,n(C)增大,与图象一致,故C正确;
D.相同压强下,升高温度平衡逆向移动,A的转化率减小;相同温度下增大压强平衡正向移动,A的转化率增大,与图象不符,故D错误;
故选C.
该反应为气体体积减小的反应,且为放热反应,则增大压强、降低温度,均可使平衡正向移动,且压强越大、温度越高,反应速率越快,以此来解答.

【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: ①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使凹液面处于“0”刻度以下的位置,记下读数;
②将锥形瓶用蒸馏水洗净后,直接从碱式滴定管中放入20.00mL待测溶液到锥形瓶中;
③将酸式滴定管用蒸馏水洗净后,立即向其中注入0.2000mol/L标准稀硫酸溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;
向锥形瓶中滴入几滴酚酞作指示剂,进行滴定,测出所耗硫酸的体积;
⑤重复以上过程.
试回答下列问题:
(1)当滴入最后一滴稀硫酸时, , 可判断达到滴定终点.
(2)滴定过程中,下列会导致滴定结果偏低的是
A.若记录读数时,起始时仰视,终点时俯视
B.滴定前向锥形瓶中加入10mL蒸馏水,其余操作正常
C.若配制硫酸时,定容时俯视刻度,其他操作正常
D.酸式滴定管在装酸液前未用待测硫酸溶液润洗
E.开始实验时碱式滴定管尖嘴部分有气泡,滴定结束气泡消失
(3)测定操作中有一步存在问题,该步骤是:(填序号)
(4)根据下列数据:
滴定次数 | 待测液体积(mL) | 标准硫酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.50 | 25.45 |
第二次 | 20.00 | 4.00 | 29.05 |
第三次 | 20.00 | 3.00 | 30.00 |
第四次 | 20.00 | 2.00 | 27.00 |
请计算待测烧碱溶液的浓度为mol/L.
(5)为了测定产品中(NH4)2Cr2O7的含量,称取样品0.150 0g,置于锥形瓶中,加50mL水,再加入2g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,加入3mL 0.5%淀粉溶液并稀释成250ml溶液,取25ml该溶液,用0.010 0mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为 . (假定杂质不参加反应,已知:①Cr2O72﹣+6I﹣+14H+=2Cr3++3I2+7H2O,I2+2S2O32﹣=2I﹣+S4O62﹣;②(NH4)2Cr2O7的摩尔质量为252g/moL).