题目内容
17.世界年产量95%以上的H2O2由蒽醌氧化法生产.反应过程如下:①
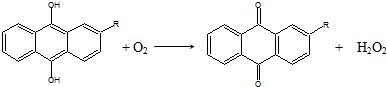
②
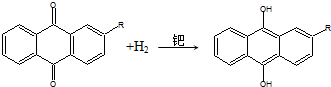
下列说法不正确的是( )
| A. | H2O2可用作漂白剂、消毒剂,也可作为火箭燃料 | |
| B. | H2O2可使湿润的KI淀粉试纸变蓝 | |
| C. | 蒽醌氧化法生产H2O2的实际结果是H2和O2生成H2O2 | |
| D. | H2O2化学性质稳定,便于储存和运输 |
分析 过氧化氢含有过氧键,具有强氧化性,可作漂白剂、消毒剂,对比两步反应可知,两步反应相加为H2+O2=H2O2,反应前后乙基蒽醌不变,应为该反应的催化剂,以此解答该题.
解答 解:A.过氧化氢含有过氧键,具有强氧化性,可作漂白剂、消毒剂,故A不选;
B.过氧化氢具有强氧化性,可氧化KI生成碘,使淀粉变蓝色,故B不选;
C.对比两步反应可知,两步反应相加为H2+O2=H2O2,反应前后乙基蒽醌不变,应为该反应的催化剂,故C不选;
D.过氧化氢具有强氧化性,易与还原性物质反应,催化条件下易分解,故D选.
故选D.
点评 本题考查有机合成反应原理的探讨,题目难度不大,本题注意把握反应机理的探讨,注意催化剂的性质,把握绿色化学的定义.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
8.下列反应的离子方程式正确的是( )
| A. | H2S通入CuSO4溶液中 S2-+Cu2+=CuS↓ | |
| B. | AgCl投入KI溶液中 Ag++I-=AgI↓ | |
| C. | Na2S的水解反应 S2-+2H2O?H2S+2OH- | |
| D. | NH4NO3溶液呈酸性 NH4++H2O?NH3•H2O+H+ |
12.高中化学学习过程中的物质颜色是需要注意的.下列关于颜色的描述正确的个数是( )
①氯水放久了会逐渐由黄绿色变成几乎无色
②AgBr见光分解会生成银白色的银
③KI溶液中加入淀粉溶液会变成紫色
④碘水中加入CCl4振荡静置后,下层紫红色
⑤钠在氯气中燃烧火焰为黄色.
①氯水放久了会逐渐由黄绿色变成几乎无色
②AgBr见光分解会生成银白色的银
③KI溶液中加入淀粉溶液会变成紫色
④碘水中加入CCl4振荡静置后,下层紫红色
⑤钠在氯气中燃烧火焰为黄色.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
2.某校化学小组学生利用如图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO.(图中夹持装置及尾气处理装置均已略去)
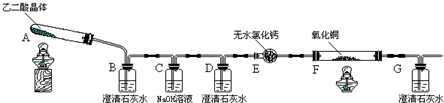
(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量固体与试管中,加稀硫酸,若溶液变蓝色,说明有Cu2O,若溶液不变色,则不含有Cu2O
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
KMnO4溶液的物质的量浓度的计算式是c(KMnO4)=$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.

(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量固体与试管中,加稀硫酸,若溶液变蓝色,说明有Cu2O,若溶液不变色,则不含有Cu2O
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
9.下列变化规律正确的是( )
| A. | 半径:Li>Na>K>Rb | |
| B. | 酸性:HClO4>H2SO4>H3PO4>H2CO3 | |
| C. | 气态氢化物的稳定性:HI>HBr>HCl>HF | |
| D. | 还原性:Cl->Br->I->S2- |
6.HClO是比H2CO3还弱的酸,为了提高氯水中HClO的浓度,可加入( )
| A. | H2O | B. | CaO(s) | C. | CaCO3 (s) | D. | NaOH (s) |
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
 ;
; .
.