题目内容
16.下列物质间转化需要加入还原剂才能实现的是( )| A. | N2→NH3 | B. | Fe2+→Fe3+ | C. | CaCO3→CO2 | D. | Al→NaAlO2 |
分析 需要加入还原剂才能实现,则选项中为氧化剂的变化,氧化剂中某元素的化合价降低,以此来解答.
解答 解:A.N元素的化合价降低,需要加还原剂实现,故A正确;
B.Fe元素的化合价升高,需要加氧化剂实现,故B错误;
C.没有元素的化合价变化,不发生氧化还原反应,故C错误;
D.Al元素的化合价升高,需要加氧化剂实现,故D错误.
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中的元素化合价变化为解答的关键,侧重氧化剂发生的反应的考查,注意从化合价角度分析,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
6.在同温同压下,下列各组热化学方程式中,Q1>Q2的是( )
| A. | 2H2(g)+O2(g)=2H2O(l);△H=Q1 2H2(g)+O2(g)=2H2O(g);△H=Q2 | |
| B. | S(g)+O2(g)=SO2(g);△H=Q1 S(s)+O2(g)=SO2(g)△H=Q2 | |
| C. | C(s)+0.5O2(g)=CO(g);△H=Q1 C(s)+O2(g)=CO2(g);△H=Q2 | |
| D. | H2(g)+Cl2(g)=2HCl(g);△H=Q1 0.5H2(g)+0.5 Cl2(g)=HCl(g);△H=Q2 |
7.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,0.05 NA个CO2分子所占的体积是1.12 L | |
| B. | 把200 mL 1.5 mol•L-1的BaCl2溶液跟100 mL 3 mol•L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol•L-1(忽略混合后溶液体积的变化) | |
| C. | 常温常压下,32 g氧气和32 g H2S分子个数比为1:1 | |
| D. | 标准状况下,NA个水分子所占的体积为22.4 L |
4.化工塑料PE指的是( )
| A. | 聚氯乙烯 | B. | 聚丙烯 | C. | 聚丙烯腈 | D. | 聚乙烯 |
11.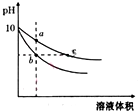 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )
 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | 稀释之前,两溶液导电能力相同 | |
| C. | a、b、c三点溶液中水的电离程度c>a>b | |
| D. | 用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vc>Vb |
1.如表是不同温度下水的离子积常数:
请回答以下问题:
(1)25℃时,将pH=8的Ba(OH)2溶液稀释1000倍,则稀释后的溶液中c(Ba2+)与c(OH-)之比为1:200.
(2)t1℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.
| 温度/℃ | 25 | t1 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
(1)25℃时,将pH=8的Ba(OH)2溶液稀释1000倍,则稀释后的溶液中c(Ba2+)与c(OH-)之比为1:200.
(2)t1℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.
8.下列事实不能用勒夏特列原理解释的是( )
| A. | 对盛在烧杯(敞口)内的氨水加热,氨水中NH${\;}_{4}^{+}$浓度减小 | |
| B. | 对石灰的悬浊液加热使温度升高,悬浊液中Ca(OH)2固体的含量增加 | |
| C. | 高压有利于合成氨的反应 | |
| D. | 500℃左右比室温更有利于合成氨的反应 |
5.下列关于有机化合物的说法正确的是( )
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | 氰酸铵(NH4OCN)与尿素[CO(NH2)2]都是共价化合物 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
6.下列单体中,在一定条件下能发生加聚反应生成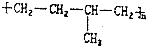 的是( )
的是( )
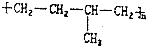 的是( )
的是( )| A. | 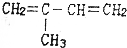 | B. | 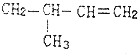 | ||
| C. | CH3CH═CH2和CH2═CH2 | D. | CH3CH═CH2 |