题目内容
1.如表是不同温度下水的离子积常数:| 温度/℃ | 25 | t1 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
(1)25℃时,将pH=8的Ba(OH)2溶液稀释1000倍,则稀释后的溶液中c(Ba2+)与c(OH-)之比为1:200.
(2)t1℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.
分析 (1)计算出pH=8的溶液中氢氧根离子浓度,从而得出氢氧化钡的浓度,再根据稀释过程中钡离子的物质的量不变计算出稀释后钡离子的浓度;氢氧根离子在稀释过程中浓度只能无限接近1×10-7mol/L,据此计算出稀释后的溶液中c(Ba2+)与c(OH-)之比;
(2)t1℃时水的离子积为1×10-12,据此计算出pH=11、pH=2、pH=2的溶液中氢氧根离子、氢离子浓度,然后列式计算即可.
解答 解:(1)pH=8的溶液中氢氧根离子的浓度为c(OH-)=10-6mol/L,则氢氧化钡的浓度为5×10-7mol/L,稀释1000倍后钡离子的浓度为:5×10-7mol/L×$\frac{1}{1000}$=5×10-10mol/L,而在稀释过程中不可能变为酸性,溶液中氢氧根离子浓度只能接近1×10-7mol/L,
所以稀释后的溶液中c(Ba2+)与c(OH-)之比为5×10-10mol/L:1×10-7mol/L=1::200,
故答案为:1:200;
(2)t1℃时,将pH=11的苛性钠中氢氧根离子浓度为:c(OH-)=$\frac{1×1{0}^{-12}}{1×1{0}^{-11}}$mol/L=0.1mol/L,
pH=1的稀硫酸中氢离子浓度为0.1mol/L,
pH=2的溶液中氢离子浓度为0.01mol/L,
则混合液中满足:0.1mol/L×V2-0.1mol/L×V1=0.01mol/L×(V1+V2),
整理可得:V1:V2=9:11,
故答案为:9:11.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
11.下列括号内的气体是需要检验的杂质,检验的方法合理的是( )
| A. | H2、CO2(CO)$→_{△}^{CuO}$ $\stackrel{Ca(OH)_{2}溶液}{→}$ | |
| B. | H2(CO2、HCl)$\stackrel{AgNO_{3}}{→}$ $\stackrel{Ca(OH)_{2}溶液}{→}$ | |
| C. | O2(CO)$→_{△}^{CuO}$ $\stackrel{Ca(OH)_{2}溶液}{→}$ | |
| D. | CO(H2O、CO2)$\stackrel{浓H_{2}SO_{4}}{→}$ $\stackrel{Ca(OH)_{2}溶液}{→}$ |
12.已知:①2FeCl3+2KI═2FeCl2+2KCl+I2 ②2FeCl2+Cl2═2FeCl3,判断下列物质的氧化能力由强到弱的顺序是( )
| A. | FeCl3>Cl2>I2 | B. | Cl2>FeCl3>I2 | C. | I2>Cl2>FeCl3 | D. | Cl2>I2>FeCl3 |
9.在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL0.1mol•L-1醋酸溶液相比,下列数值前者小于后者的是( )
| A. | 中和时所需的NaOH的量 | B. | 电离程度 | ||
| C. | H+的物质的量 | D. | CH3COOH分子的物质的量 |
16.下列物质间转化需要加入还原剂才能实现的是( )
| A. | N2→NH3 | B. | Fe2+→Fe3+ | C. | CaCO3→CO2 | D. | Al→NaAlO2 |
6.已知①C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q1 kJ•mol-1;②C2H5OH(g)═C2H5OH(l)△H2=-Q2 kJ•mol-1;③H2O(g)=H2O(l)△H3=-Q3 kJ•mol-1;若使92g液体酒精完全燃烧,恢复到室温,则放出的热量为( )
| A. | (4Q1+4Q2+4Q3)kJ | B. | (2Q1-2Q2+6Q3)kJ | C. | [2(Q1+Q2+Q3)]kJ | D. | (2Q1-6Q2+2Q3)kJ |
11.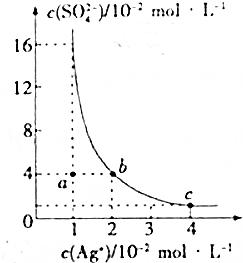 某温度时,Ag2SO4在水溶液中的溶解平衡曲线如图所示,下列说法不正确的是( )
某温度时,Ag2SO4在水溶液中的溶解平衡曲线如图所示,下列说法不正确的是( )
 某温度时,Ag2SO4在水溶液中的溶解平衡曲线如图所示,下列说法不正确的是( )
某温度时,Ag2SO4在水溶液中的溶解平衡曲线如图所示,下列说法不正确的是( )| A. | b点对应的Ksp(Ag2SO4)等于c点对应的Ksp(Ag2SO4) | |
| B. | 采取蒸发溶剂的犯法可以使a点对应的溶液变为b点对应的溶液 | |
| C. | 该温度下,Ksp(Ag2SO4)=1.6×10-5 | |
| D. | 0.02mol•L-1的AgNO3溶液与0.2mol•L-1的Na2SO4溶液等体积混合不会生成沉淀 |