题目内容
11.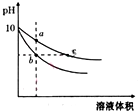 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | 稀释之前,两溶液导电能力相同 | |
| C. | a、b、c三点溶液中水的电离程度c>a>b | |
| D. | 用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vc>Vb |
分析 NaOH是强电解质,CH3COONa是强碱弱酸盐,加水稀释促进醋酸根离子水解,稀释相同的倍数时,溶液中c(OH-):CH3COONa>NaOH,所以pH变化大的是NaOH,变化小的是CH3COONa,
A.溶液的导电能力与离子浓度成正比;
B.pH相等的NaOH和CH3COONa溶液,c(CH3COONa)>c(NaOH);
C.酸或碱抑制水电离,含有弱离子的盐促进水电离;
D.pH相等的NaOH和CH3COONa溶液,c(CH3COONa)>c(NaOH),相同体积相同pH的醋酸钠和氢氧化钠溶液消耗相同浓度的盐酸体积与氢氧化钠和醋酸钠的物质的量成正比.
解答 解:NaOH是强电解质,CH3COONa是强碱弱酸盐,加水稀释促进醋酸根离子水解,稀释相同的倍数时,溶液中c(OH-):CH3COONa>NaOH,所以pH变化大的是NaOH,变化小的是CH3COONa,
A.溶液的导电能力与离子浓度成正比,pH相等的醋酸钠和氢氧化钠,c(CH3COONa)>c(NaOH),所以c点导电能力大于b,即b、c两点溶液的导电能力不相同,故A错误;
B.溶液的导电能力与离子浓度成正比,pH相等的醋酸钠和氢氧化钠,c(CH3COONa)>c(NaOH),所以稀释之前,两溶液导电能力不同,故B错误;
C.氢氧化钠对水的电离起抑制作用,而醋酸根离子浓度越大对水的电离程度越促进,所以、b、c三点溶液中水的电离程度a>c>b,故C错误;
D.pH相等的NaOH和CH3COONa溶液,c(CH3COONa)>c(NaOH),相同体积相同pH的醋酸钠和氢氧化钠溶液消耗相同浓度的盐酸体积与氢氧化钠和醋酸钠的物质的量成正比,相同体积相同pH的醋酸钠和氢氧化钠溶液n(CH3COONa)>n(NaOH),所以醋酸钠消耗盐酸多,消耗盐酸体积Vc>Vb,故D正确;
故选D.
点评 本题考查了盐类水解,涉及离子浓度大小比较、溶液导电能力大小比较、水的电离程度等知识点,根据溶液中的溶质及其性质是解本题关键,再结合质子守恒、溶液导电能力与离子浓度的关系等知识点来分析解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2.无隔膜法电解冷的食盐水相应的离子方程式为Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑.
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

①经精制的饱和NaCl溶液应从图中电解池的左(填写“左”或“右”)池注入.
②图中X是Cl2(填化学式);乙中右室的电极反应式为:O2+4e-+2H2O=4OH-,③图示中氢氧化钠溶液质量分数a%与b%的关系是B(填字母).
A.a%=b% B.a%>b% C.a%<b%
(3)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为:
c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
| A. | 21:5 | B. | 2:1 | C. | 4:1 | D. | 11:3 |
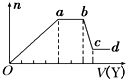 某无色稀溶液X中,可能含有如表所列离子中的某几种.
某无色稀溶液X中,可能含有如表所列离子中的某几种.| 阴离子 | CO${\;}_{3}^{2-}$、SiO${\;}_{3}^{2-}$、AlO${\;}_{3}^{-}$、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH${\;}_{4}^{+}$、Na+ |
| A. | 若Y是盐酸,则X中一定含有CO${\;}_{3}^{2-}$、SiO${\;}_{3}^{2-}$、AlO${\;}_{2}^{-}$和NH${\;}_{4}^{+}$ | |
| B. | 若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH${\;}_{4}^{+}$、Cl- | |
| C. | 若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH${\;}_{4}^{+}$+OH-=NH3↑+H2O | |
| D. | 若Y是NaOH溶液,则X中的Al3+、Mg2+、NH${\;}_{4}^{+}$物质的量之比为2:1:4 |
| A. | 氯气可用于自来水消毒 | |
| B. | 40%的甲醛水溶液可用作防腐剂,浸制生物标本 | |
| C. | 工业酒精可用于酿造饮用酒 | |
| D. | 煤的气化和液化主要是生成清洁燃料,煤的干馏主要是生产化工原料 |
| A. | N2→NH3 | B. | Fe2+→Fe3+ | C. | CaCO3→CO2 | D. | Al→NaAlO2 |
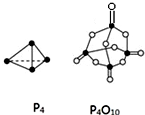 参考如表键能数据和相关物质结构模型,估算热化学方程式:Si(s)+O2(g)═SiO2(s)、P4(s,白磷)+5O2(g)═P4O10(s)中,△H的值分别为( )
参考如表键能数据和相关物质结构模型,估算热化学方程式:Si(s)+O2(g)═SiO2(s)、P4(s,白磷)+5O2(g)═P4O10(s)中,△H的值分别为( )| 化学键 | Si-O | O=O | Si-Si | P-P | P-O | P=O | O=O |
| 键能kJ•mol-1 | 460 | 498.8 | 176 | a | b | c | d |
| A. | -61.2 kJ•mol-1、(4c+12b-4a-5d)kJ•mol-1 | |
| B. | -989.2 kJ•mol-1、(4c+12b-6a-5d)kJ•mol-1 | |
| C. | -989.2 kJ•mol-1、(6a+5d-4c-12b)kJ•mol-1 | |
| D. | -245.2 kJ•mol-1、(4a+5d-4c-12b)kJ•mol-1 |
| A. | Mg2+、K+、NO3-、OH- | B. | Ba2+、NH4+、NO3-、OH- | ||
| C. | Ca2+、K+、SO42-、Cl- | D. | Ba2+、Na+、Cl-、NO3- |
| A. | 直接往该溶液中滴加稀H2S04后产生大量气泡,证明原溶液含C032- | |
| B. | 取少量溶液加入Ba(NO3)2溶液后产生白色沉淀,证明原溶液中含SO42- | |
| C. | 取少量溶液加入HCl酸化后滴加AgN03溶液产生白色沉淀,证明原溶液中含Cl-. | |
| D. | 取少量溶液加入HCl酸化后滴加BaCL2溶液产生白色沉淀,证明原溶液中含SO42- |