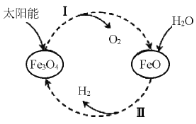
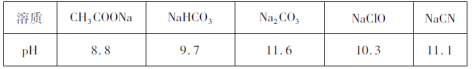
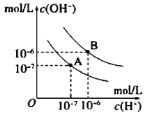
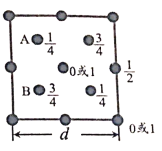
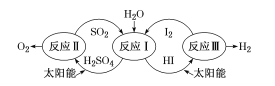
题目内容
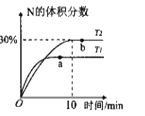
【题目】将2molX和0.8molY置于体积为2L的恒容密闭容器中,发生反应:2X(g)+Y(s)![]() M(g)+N(g) △H。反应过程中测得N的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
M(g)+N(g) △H。反应过程中测得N的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
A.无论温度为T1还是T2,当容器中气体密度不变或压强不变时,反应达平衡状态
B.温度为T2时,X的平衡转化率为60%,平衡常数K=5.625
C.T1、T2的平衡常数分别为K1、K2,则K1<K2
D.降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
【答案】C
【解析】
A.该反应前后气体计量数之和不变,则反应前后气体物质的量不变,恒温恒容时气体压强始终不变,反应前后气体物质的质量是个变值,不能根据压强判断平衡状态,恒温恒容时,气体的密度是个变值,可以根据气体密度不变判断平衡状态,故A错误;
B.温度为T2时,X的平衡转化率为60%,则消耗的n(X)=1mol/L×60%=0.6mol/L,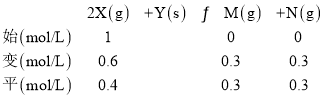
则K=![]() =0.5625,故B错误;
=0.5625,故B错误;
C.根据“先拐先平数值大”知,T1>T2,升高温度N的含量降低,则平衡逆向移动,逆反应方向为吸热反应,则该反应是放热反应,升高温度平衡常数减小,则T1、T2的平衡常数分别为K1、K2,则K1<K2,故C正确;
D.降低温度、及时分离出产物都使平衡正向移动,有利于提高反应物的平衡转化率,反应前后气体计量数之和不变,增大压强,平衡不移动,转化率不变,故D错误;
答案选C。

练习册系列答案
相关题目