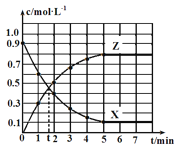
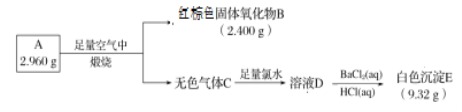
题目内容
【题目】有下列物质:
①硫酸 ②盐酸 ③氯气 ④硫酸钡 ⑤酒精 ⑥铜 ⑦醋酸 ⑧氯化氢 ⑨蔗糖 ⑩氨气 CO2 NaHCO3 A l(OH)3 NaOH
(1)属于非电解质的为____(填序号,下同),属于弱电解质的为___,能导电的是___。
(2)写出下列反应的离子方程式
①NaHCO3溶于醋酸:______________________。
②过量CO2与NaOH溶液反应:______________。
③Cl2通入NaOH溶液中:___________________。
【答案】⑤⑨⑩ ⑦ ②⑥ HCO![]() +CH3COOH===CH3COO-+CO2↑+H2O CO2+OH-===HCO
+CH3COOH===CH3COO-+CO2↑+H2O CO2+OH-===HCO![]() Cl2+2OH-===Cl-+ClO-+H2O
Cl2+2OH-===Cl-+ClO-+H2O
【解析】
(1)根据物质分类来判断物质的类别;
(2)②过量的CO2生成碳酸氢盐;
(1)属于非电解质的化合物包括大多数有机物、非金属氧化物、某些非金属氢化物等。⑤酒精,乙醇属于有机物;⑨蔗糖,属于有机物;⑩氨气,非金属的氢化物,在水溶液中不电离;CO2,非金属氧化物;属于非电解质的包括⑤⑨⑩;
弱电解质包括弱酸、弱碱、两性氢氧化物、水等;⑦醋酸,弱酸;Al(OH)3,属于两性氢氧化物。属于弱电解质的包括⑦;
能导电的物质有自由移动的电子,如金属单质,或有自由移动的离子,如电解质溶液。②盐酸,HCl的水溶液,有自由移动的H+和Cl-,可以导电;⑥铜,金属单质,有自由移动的电子能够导电。能够导电的包括②⑥;
(2)①醋酸是弱酸不能拆成离子形式,HCO3-是弱酸的酸式根离子也不能拆,生成的碳酸不稳定,分解为CO2和水,离子方程式为HCO![]() +CH3COOH=CH3COO-+CO2↑+H2O;
+CH3COOH=CH3COO-+CO2↑+H2O;
②过量的CO2生成酸式盐,NaOH为强碱,可以拆开,离子方程式为:CO2+OH-=HCO3-;
③氯气与氢氧化钠反应,为歧化反应生成氯化钠和次氯酸钠,产物均为溶于水的强电解质,可以拆成离子形式;离子方程式为Cl2+2OH-===Cl-+ClO-+H2O。

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中________(填元素符号)的非金属性最强;________(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:___________________________________________________。
(2)表中元素③的原子结构示意图是____________。
(3)表中元素⑥、⑦的氢化物的稳定性顺序为
(4)表中元素最高价氧化物对应水化物酸性最强的是________(填化学式)。