题目内容
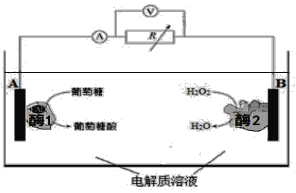
【题目】在一定的温度、压强和钒催化剂存在的条件下,SO2被空气中的O2氧化为SO3。V2O5是钒催化剂的活性成分,郭汗贤等提出:V2O5在对反应I的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,图示如图1:
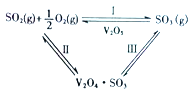
图1
(1)①已知有关气体分子中1mol化学键断裂时需要吸收的能量数据如下:
化学键 | S=O(SO2) | O=O(O2) | S=O(SO3) |
能量/kJ | 535 | 496 | 472 |
由此计算反应Ⅰ的△H=_________kJ·mol-1。
②写出反应Ⅱ的化学方程式_________。
(2)不能说明反应Ⅰ达到平衡状态的是_________。
A.恒容密闭容器中混合气体的压强不再变化
B.恒容密团容器中混合气体的密度不再变化
C.混合气体的总物质的量不再变化
D.混合气体的平均相对分子质量不再变化
E.n(SO2)∶n(O2)∶n(SO3)=2∶1∶2
F.SO2气体的百分含量不再变化
(3)在保持体系总压为105Pa的条件下进行反应SO2+1/2O2![]() SO3,原料气中SO2和O2的物质的量之比m(m=
SO3,原料气中SO2和O2的物质的量之比m(m=![]() )不同时,SO2的平衡转化率与温度(t)的关系如下图所示:
)不同时,SO2的平衡转化率与温度(t)的关系如下图所示:
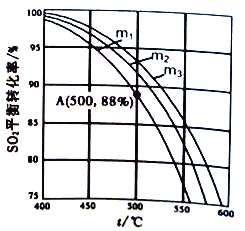
①图中m1、m2、m3的大小顺序为_________,理由是_________。
②反应I的化学平衡常数Kp表达式为_________(用平衡分压代替平衡浓度表示)。图中A点原料气的成分是:n(SO2)=10mol,n(O2)=24.4mol,n(N2)=70mol,达平衡时SO2的分压p(SO2)为_________Pa。(分压=总压×物质的量分数)。
③近年,有人研发出用氧气代替空气的新工艺,使SO2趋于全部转化。此工艺的优点除了能充分利用含硫的原料外,主要还有_________。
【答案】 -98 SO2 + V2O5![]() V2O4·SO3 B E m1>m2>m3 相同温度和压强下,若SO2浓度不变,O2浓度增大,转化率提高,m值减小。 Kp=
V2O4·SO3 B E m1>m2>m3 相同温度和压强下,若SO2浓度不变,O2浓度增大,转化率提高,m值减小。 Kp=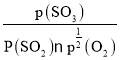
![]() =1200Pa( 无尾气排放,不污染环境
=1200Pa( 无尾气排放,不污染环境
【解析】(1)①反应热等于反应物的总键能减生成物的总键能;则反应I的△H=(2×535)+0.5×496-3×472=-98kJ/mol;正确答案:-98;
②反应Ⅱ生成V204S03,方程式为S02+V205V204S03,反应ⅢV204S03与氧气反应生成V205和S03,方程式为2V204S03+022V205+S03,故答案为:S02+V205V204S03;
(2)该反应为反应前后气体的总量不为0的反应,恒容密闭容器中混合气体的压强不再变化,反应达平衡状态;A正确;反应前后气体的总质量不变,恒容密团容器中混合气体的密度恒为常数,无法判断反应是否达到平衡状态;B错误;该反应为反应前后气体的总量不为0的反应,合气体的总物质的量不再变化,反应达平衡状态;C正确;反应前后气体的总质量不变,混合气体的总量在变化,当混合气体的平均相对分子质量不再变化,反应达平衡状态;D正确;n(SO2)∶n(O2)∶n(SO3)=2∶1∶2,无法判定反应达平衡状态,E错误;反应达平衡状态,各组分的浓度保持不变;SO2气体的百分含量不再变化,可以判定反应达平衡状态;F正确;正确选项:B E ;
(3)根据图像可知:m=![]() ,m越大,二氧化硫转化率越小;原因相同温度和压强下,若SO2浓度不变,增大氧气的浓度,氧气的转化率减少,SO2的转化率增大;正确答案:
,m越大,二氧化硫转化率越小;原因相同温度和压强下,若SO2浓度不变,增大氧气的浓度,氧气的转化率减少,SO2的转化率增大;正确答案:
m1>m2>m3 ;相同温度和压强下,若SO2浓度不变,O2浓度增大,转化率提高,m值减小;
②根据反应:SO2(g)+1/2O2(g) ![]() SO3(g),其他条件不变时,化学平衡常数Kp为生成物的平衡分压与反应物的平衡分压的分压幂之比;平衡常数可以用压强表示为:Kp=
SO3(g),其他条件不变时,化学平衡常数Kp为生成物的平衡分压与反应物的平衡分压的分压幂之比;平衡常数可以用压强表示为:Kp=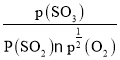 ;
;
根据题给信息,压强为Pa,二氧化硫的转化率为88%;n(SO2)=10mol,n(O2)=24.4mol, n(N2)=70mol,进行如下计算:
SO2(g) + 1/2O2(g) ![]() SO3(g),
SO3(g),
起始量: 10 24.4 0
变化量: 10×88% 0.5×10×88% 10×88%
平衡量:10×12% 24.4-5×88% 10×88%
平衡时,混合气体总量为10×12%+24.4-5×88%+10×88%+70=104.4-5×88%=100mol
达平衡时SO2的分压p(SO2)为10×12%×105 ÷100×100%=1200 Pa;正确答案:1200 Pa;
③使二氧化硫气体趋于全部转化为三氧化硫,这样就没有二氧化硫气体的剩余,减少了对环境的污染;正确答案:无尾气排放,不污染环境;

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案