题目内容
9.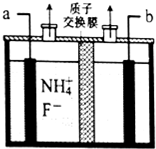 工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示.则a极为阳极,该极的电极反应式NH4++3F--6e-=NF3+4H+,用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于覆盖保护层法.
工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示.则a极为阳极,该极的电极反应式NH4++3F--6e-=NF3+4H+,用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于覆盖保护层法.
分析 NH4+被氧化生成NF3气体,则a为阳极,b为阴极,用电镀法在铁板表面镀锌或锡可隔绝空气而防腐.
解答 解:由图可知,NH4+被氧化生成NF3气体,则a为阳极,b为阴极,阳极上铵根失去电子生成NF3,电极反应方程式为:NH4++3F--6e-=NF3+4H+,用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于覆盖保护层法,
故答案为:阳;NH4++3F--6e-=NF3+4H+;覆盖保护层.
点评 本题主要考查的是电解池反应原理等,注意结合装置图分析判断电极反应及产物,难度不大,注意整理归纳.

练习册系列答案
相关题目
19.下列说法错误的是( )
| A. | 乙炔和苯均为不饱和烃,都能发生加成反应 | |
| B. | 加新制的Cu(OH)2悬浊液并加热可检验尿液中的葡萄糖 | |
| C. | 油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 水果因含有酯类物质而具有香味 |
20.理论上下列反应不能设计成原电池反应的是( )
| A. | Fe+2H+═Fe2++H2↑ | B. | 2Fe3++Cu═2Fe2++Cu2+ | ||
| C. | 2H2+O2═2H2O | D. | H++OH-═H2O |
17.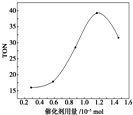 在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH-→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )
在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH-→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )
 在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH-→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )
在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH-→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )| A. | 由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义 | |
| B. | 在反应体系中添加合适的吸水剂,将提高该反应的TON | |
| C. | 当催化剂用量为1.2×10-5 mol时,该反应的TON达到最高点 | |
| D. | 当催化剂用量高于1.2×10-5 mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低 |
14.用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)大于c(Na+).对该混合溶液的下列判断正确的是( )
| A. | c(OH-)>c(H+) | B. | c(CH3COOH)+c(CH3COO-)=0.2 mol•L-1 | ||
| C. | c(CH3COOH)>c(CH3COO- ) | D. | c(CH3COO- )+c(OH- )=0.2 mol•L-1 |
1.在容积固定的密闭容器中发生反应:2NO+O2?2NO2,不能判断该反应达到到平衡状态的是( )
| A. | 单位时间内生成nmolO2的同时,生成2nmolNO2 | |
| B. | NO2?NO?O2反应速率的比为2:2:1 | |
| C. | 混合气体的颜色不再改变的状态 | |
| D. | 混合气体的压强不再改变的状态 |
18. 我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,电池总反应为:4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )
我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,电池总反应为:4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )
 我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,电池总反应为:4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )
我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,电池总反应为:4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )| A. | 铝板是电池的正极 | |
| B. | 电池工作时铝板逐渐被消耗 | |
| C. | 电池工作时实现了化学能向电能的转化 | |
| D. | 将铂电极做成网状,可增大与氧气的接触面积 |