题目内容
20.理论上下列反应不能设计成原电池反应的是( )| A. | Fe+2H+═Fe2++H2↑ | B. | 2Fe3++Cu═2Fe2++Cu2+ | ||
| C. | 2H2+O2═2H2O | D. | H++OH-═H2O |
分析 自发进行的放热的氧化还原反应能设计成原电池,有电子转移的化学反应是氧化还原反应,其特征是有元素化合价升降,据此分析解答.
解答 解:自发进行的放热的氧化还原反应能设计成原电池,有电子转移的化学反应是氧化还原反应,ABC中都有元素化合价升降,所以都是氧化还原反应,且都是放热反应,所以能设计成原电池;D中没有元素化合价升降,所以不是氧化还原反应,不能设计成原电池,故选D.
点评 本题考查原电池原理和氧化还原反应,明确原电池反应特点是解本题关键,熟悉常见元素化合价及反应热效应即可解答,题目难度不大.

练习册系列答案
相关题目
10.根据下列事实所作出的结论正确的是( )
| 选项 | 事实 | 结论 |
| A | 完全燃烧产物是CO2和H2O的物质 | 一定只含C、H元素 |
| B | 灼烧棉织品、羊毛衫和涤纶衣物 | 有烧焦羽毛气味的是羊毛衫 |
| C | 在淀粉溶液中加入市售的加碘食盐不出现蓝色 | 说明此盐一定不含碘 |
| D | 甲乙两种有机物,相对分子质量相同,结构不同 | 甲和乙一定是同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
11.下列各组有机物,不论按何种比例混合,只要总质量一定,完全燃烧生成水的总质量就相同的是( )
| A. | 甲烷、丙烷 | B. | 甲苯、甘油 | C. | 甲酸、乙酸 | D. | 乙醇、乙二醇 |
8.在a mL浓度为c mol•L-1的AgNO3溶液中加入一定体积的pH=l的盐酸时,恰好使溶液中的Ag+完全沉淀,此时得到pH=2的溶液100mL (设反应前后溶液体积变化忽略不计),则c的值是( )
| A. | 0.002 0 | B. | 0.011 | C. | 0.11 | D. | 0.22 |
15.下列变化属于物理变化的是( )
| A. | 煤的干馏 | B. | 石油的分馏 | C. | 石油的裂化 | D. | 煤的气化 |
5.锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
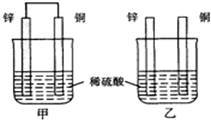

| A. | 两烧杯中溶液的氢离子浓度均减小 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中铜片表面均有气泡产生 | D. | 甲、乙溶液均变蓝色 |
10.下列有机物命名正确的是( )
| A. | 3,4,4-三甲基-1-戊炔 | B. | 2,2-二甲基-3-丁烯 | ||
| C. | 2,3,4,4-四甲基戊烷 | D. | 1,3,4-三甲基苯 |
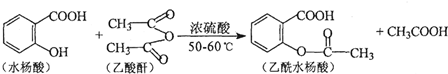
 (任意一种).
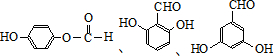
(任意一种). (不写条件).
(不写条件). .
.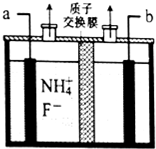 工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示.则a极为阳极,该极的电极反应式NH4++3F--6e-=NF3+4H+,用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于覆盖保护层法.
工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示.则a极为阳极,该极的电极反应式NH4++3F--6e-=NF3+4H+,用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于覆盖保护层法.