题目内容
1.下列反应属于加成反应的是( )| A. | 甲烷与氯气反应 | B. | 乙烷的燃烧 | ||
| C. | 乙烯使酸性高锰酸钾溶液褪色 | D. | 乙烯使溴水褪色 |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;
有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应;
常见能发生加成反应的物质往往含有C=C、C≡C、C=O等官能团,以此解答该题.
解答 解;A.甲烷在光照条件下与氯气发生取代反应,故A错误;
B.乙烷的燃烧为氧化还原反应,故B错误;
C.乙烯中含有碳碳双键,能够被酸性高锰酸钾溶液氧化,从而酸性高锰酸钾溶液褪色,该反应为氧化反应,故C错误;
D.乙烯含有碳碳双键,可与溴水发生加成反应1,2-二溴乙烷,故D正确;
故选D.
点评 本题考查有机物的结构和性质,为高频考点,题目难度不大,侧重于有机物反应类型的判断,注意把握有机物的官能团的性质以及转化,注意相关基础知识的积累.

练习册系列答案
相关题目
12.减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题.
Ⅰ.(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H 在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系.
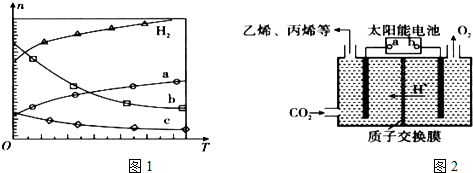
①该反应的△H<0(填“>”、“=”或“<”).
②曲线b表示的物质为H2O.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是加压(或不断分离出水).
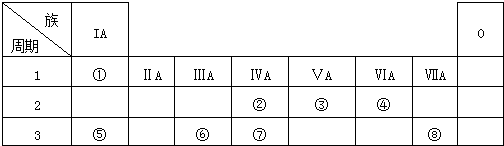
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示.
b为电源的正极,电解时,生成乙烯的电极反应式是2CO2+12e-+12H+=C2H4+4H2O.
Ⅱ.(3)用活性炭还原法可以处理氮氧化物.如反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①Tl℃时,该反应的平衡常数K=$\frac{9}{16}$.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO;适当缩小容器的体积;增大压强;通入等物质的量的CO2和N2(答一种即可).
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是NH4HSO3,用文字和化学用语解释原因HSO3-?H++SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小.
Ⅰ.(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H 在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系.

①该反应的△H<0(填“>”、“=”或“<”).
②曲线b表示的物质为H2O.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是加压(或不断分离出水).
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示.
b为电源的正极,电解时,生成乙烯的电极反应式是2CO2+12e-+12H+=C2H4+4H2O.
Ⅱ.(3)用活性炭还原法可以处理氮氧化物.如反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO;适当缩小容器的体积;增大压强;通入等物质的量的CO2和N2(答一种即可).
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是NH4HSO3,用文字和化学用语解释原因HSO3-?H++SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小.
9.下列过程中化学键没有被破坏的是( )
| A. | 水沸腾汽化 | |
| B. | 水加热到1500℃开始分解 | |
| C. | 熔融的氯化钠 | |
| D. | 煤矿中瓦斯(主要成分是甲烷)遇火爆炸 |
6.下列说法或表示方法正确的( )
| A. | 已知C(s)+O2(g)═CO2(g)△H1;C(s)+$\frac{1}{2}$O2(g)═CO (g)△H2,则△H1>△H2 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3 kJ | |
| C. | 由C(石墨)═C(金刚石);△H=+1.90kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 已知氢气的标准燃烧热为-285.8 kJ•mol-1,相应的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ•mol-1 |
13.甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( )
①甲由水电离出来的H+的物质的量浓度是乙的$\frac{1}{10}$倍
②物质的量浓度c(甲)=10c(乙)
③中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)>V(乙)
④甲中的c(OH-)为乙中的c(OH-)的10倍.
①甲由水电离出来的H+的物质的量浓度是乙的$\frac{1}{10}$倍
②物质的量浓度c(甲)=10c(乙)
③中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)>V(乙)
④甲中的c(OH-)为乙中的c(OH-)的10倍.
| A. | ①②④正确 | B. | ①③正确 | C. | ②④正确 | D. | 只有①正确 |
 .
.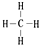 ,②和⑦的气态氢化物的稳定性相比,其中较弱的是SiH4 (用该氢化物的化学式表示).
,②和⑦的气态氢化物的稳定性相比,其中较弱的是SiH4 (用该氢化物的化学式表示). ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.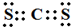 .
.