题目内容
13.实验室用如图所示仪器和药品制取干燥纯净的氯气.
(1)按气流从左到右,装置正确的连接a接f接h接b接c接e接d接g(填各接口字母)
(2)装置F的作用是除掉氯气中混有的HCl,装置E的作用是吸收多余的氯气.
(3)装置A和E中的反应化学方程式为AMnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;ECl2+2NaOH=NaClO+NaCl+H2O.
(4)某校化学兴趣小组称取8.7g二氧化锰与足量10mol•L-1的浓盐酸反应,理论上可制得氯气的体积(标准状况)V1=2.24L.
(5)若该小组量取了10mol•L-1的浓盐酸40mL,与足量的二氧化锰反应,理论上产生氯气的体积为V2(标准状况),则V1>V2(填“>”、“=”或“<”)原因是随着反应的进行,盐酸的浓度减小,反应不再进行.
分析 (1)(2)A为发生装置,生成氯气中含有HCl、水蒸气,用饱和的食盐除外HCl,用浓硫酸进行干燥,再利用向上排空气法进行收集,氯气有毒,直接排放会污染空气,E中盛放氢氧化钠溶液,吸收氯气,防止污染环境.
(3)A中是二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水;E中氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水;
(4)浓盐酸足量,二氧化锰完全反应,根据方程式计算生成氯气的体积;
(5)HCl的物质的量为0.4mol,由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知8.7g二氧化锰与0.4molHCl恰好完全反应,但随着反应的进行,盐酸的浓度减小,反应不再进行,实际得到氯气体积小于(4)中计算值.
解答 解:(1)A为发生装置,生成氯气中含有HCl、水蒸气,用饱和的食盐除外HCl,用浓硫酸进行干燥,再利用向上排空气法进行收集,氯气有毒,直接排放会污染空气,E中盛放氢氧化钠溶液,吸收氯气,防止污染环境,故装置连接为:( a )接(f )接( h )接(b)接(c )接( e )接(d)接(g),
故答案为:a;f; h;b;c;e;d;g;
(2)由(1)中分析可知,装置F的作用是:除掉氯气中混有的HCl,装置E的作用是:吸收多余的氯气,
故答案为:除掉氯气中混有的HCl;吸收多余的氯气;
(3)A中是二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
E中氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应方程式为:Cl2+2NaOH=NaClO+NaCl+H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;Cl2+2NaOH=NaClO+NaCl+H2O;
(4)浓盐酸足量,二氧化锰完全反应,生成氯气体积为V1L,则:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
87g 22.4L
8.7g V1L
故87g:8.7g=22.4L:V1L,解得V1=2.24,
故答案为:2.24;
(5)HCl的物质的量为0.04L×10mol/L=0.4mol,由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知8.7g二氧化锰与0.4molHCl恰好完全反应,但随着反应的进行,盐酸的浓度减小,反应不再进行,实际得到氯气体积小于(4)中计算值,即则V1>V2,
故答案为:>;随着反应的进行,盐酸的浓度减小,反应不再进行.
点评 本题考查氯气的实验室制备,侧重考查学生对基础知识的理解掌握,注意浓盐酸与二氧化锰反应,随着反应的进行,盐酸的浓度减小,反应不再进行.

| A. | 量筒 | B. | 碱式滴定管 | C. | 酸式滴定管 | D. | 容量瓶 |
| A. | PM2.5含有的铅、镊、铬、钒、砷等对人体有害的元素均是金属元素 | |
| B. | 合成纤维和光导纤维都是有机高分子化合物 | |
| C. | 可以用SiN4、Al2O3,制作高温结构陶瓷制品 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
| A. | 角鲨烯分子式为C30H50 | |
| B. | 角鲨烯与分子式为C29H48的物质可能属于同系物 | |
| C. | 角鲨烯完全加氢后为C30H62 | |
| D. | 1mol角鲨烯最多可与5mol溴单质加成 |
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则α>1×10-14(填“>”“<”或“=”),作出此判断的理由是
升高温度,水的电离程度增大,离子积增大.
(2)已知25℃时饱和NaHCO3溶液的PH>7,则此温度下饱和NaHCO3溶液中各离子浓度关系正确的是AC
A.c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
| A. | 鱼 | B. | 大米 | C. | 葡萄 | D. | 植物油 |
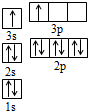 (1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.
(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4>H3PO4; HClO4>HClO3;
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.
 +6KMnO4+9H2SO4→
+6KMnO4+9H2SO4→ +3K2SO4+6MnSO4+14H2O.
+3K2SO4+6MnSO4+14H2O.