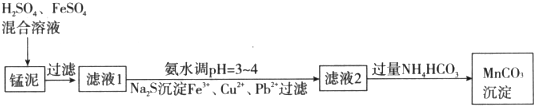
题目内容
17.下列叙述中正确的是( )| A. | 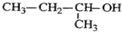 的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| B. | 软脂酸和油酸互为同系物 | |
| C. | 聚乙烯能使溴水褪色 | |
| D. | 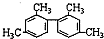 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 |
分析 A、醇类命名选取含有羟基的最长碳链为主链;
B、软脂酸为饱和一元酸,油酸为不饱和一元酸;
C、聚乙烯中不含有不饱和双键;
D、依据苯以及甲烷的结构推断该有机物中的C原子共面情况即可.
解答 解:A、醇类命名选取含有羟基的最长碳链为主链,即为丁醇,在2号碳上含有羟基,正确命名为:2-丁醇,故A错误;
B、软脂酸为饱和一元酸,油酸为不饱和一元酸,含有碳碳双键,故两者不是同系物,故B错误;
C、聚乙烯中不含有不饱和双键,故聚乙烯不能使溴水褪色,故C错误;
D、甲基与苯环平面结构通过单键相连,甲基的C原子处于苯的H原子位置,所以处于苯环这个平面,两个苯环相连,与苯环相连的碳原子处于另一个苯的H原子位置,也处于另一个苯环这个平面.如图所示(已编号) 的甲基碳原子、甲基与苯环相连的碳原子、苯环与苯环相连的碳原子,处于一条直线,共有6个原子共线,所以至少有11个碳原子共面,故D正确,
的甲基碳原子、甲基与苯环相连的碳原子、苯环与苯环相连的碳原子,处于一条直线,共有6个原子共线,所以至少有11个碳原子共面,故D正确,
故选D.
点评 本题主要考查有机化合物的结构特点和同系物概念,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
5.能与NaHCO3溶液反应产生气体,分子式为C5H10O2的同分异构体有(不考虑立体异构)( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
12.下列有关仪器使用方法或实验操作说法正确的是( )
| A. | 用湿润的pH试纸测定溶液的pH,测定结果偏小 | |
| B. | 石蕊、酚酞等酸碱指示剂均可用作中和滴定的指示剂 | |
| C. | 托盘天平称量药品时,都应垫上滤纸称量 | |
| D. | 滴定管以及容量瓶在使用前需检查是否漏水 |
2.下列有关硫及其化合物的说法正确的是( )
| A. | 浓硫酸具有吸水性,因而能使蔗糖碳化 | |
| B. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 | |
| C. | 在反应SO2+2H2S═3S+2H2O中SO2作氧化剂 | |
| D. | 硫粉在过量的纯氧中燃烧可以生成SO3 |
9.周期表中同族元素单质及其化合物在许多性质上都存在着递变规律,随着原子序数的递增,下列有关说法正确的是( )
| A. | IA族,单质的熔点逐渐降低 | |
| B. | ⅥA族,对气态氢化物还原性逐渐增强 | |
| C. | VA族氢化物的沸点逐渐升高 | |
| D. | ⅣA族最高氧化物对应水化物的酸性逐渐增强 |
6.下列表示正确的是( )
| A. | 用盐酸和淀粉-KI试纸检验碘盐中的KIO3:IO3-+5I-+6H+=3I2+3H2O | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)△H=-566.0KJ/mol | |
| C. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变溶,则溶液中一定有CO32- |
7. 室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )
室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )
 室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )
室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )| A. | 该反应平衡常数的表达式为K=c(H4SiO4) | |
| B. | 该生成H4SiO4的反应为吸热反应 | |
| C. | 用H4SiO4表示的反应速率为1.04×10-2mol/(L•h) | |
| D. | 若K值变大,在平衡移动时逆反应速率先减小后增大 |
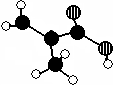 化工厂生产的某产品只含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
化工厂生产的某产品只含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).