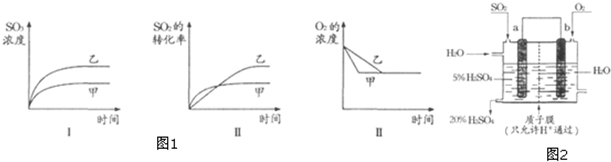
题目内容
2.下列有关硫及其化合物的说法正确的是( )| A. | 浓硫酸具有吸水性,因而能使蔗糖碳化 | |
| B. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 | |
| C. | 在反应SO2+2H2S═3S+2H2O中SO2作氧化剂 | |
| D. | 硫粉在过量的纯氧中燃烧可以生成SO3 |
分析 A.蔗糖碳化,蔗糖中H、O元素以水的形式脱出;
B.SO2通入品红溶液,与漂白性有关,且漂白为暂时性的;将SO2通入溴水发生氧化还原反应;
C.SO2中S元素的化合价由+4价降低为0;
D.S燃烧生成二氧化硫.
解答 解:A.蔗糖碳化,蔗糖中H、O元素以水的形式脱出,与浓硫酸的脱水性有关,与吸水性无关,故A错误;
B.SO2通入品红溶液,与漂白性有关,且漂白为暂时性的,则溶液褪色后加热恢复原色;而将SO2通入溴水发生氧化还原反应,溴水褪色后加热不能恢复原色,故B错误;
C.SO2中S元素的化合价由+4价降低为0,则反应SO2+2H2S═3S+2H2O中SO2作氧化剂,故C正确;
D.S燃烧生成二氧化硫,二氧化硫发生催化氧化生成三氧化硫,故D错误;
故选C.
点评 本题考查含硫物质的性质,为高频考点,涉及浓硫酸、二氧化硫及S的性质等,把握性质、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
11.a b c d四个集气瓶中装有Cl2 H2 HCl HBr的任意一种气体,若a d两瓶气体混合见光爆炸,a b两瓶气体混合瓶壁出现红棕色液滴,则a b c d瓶气体是( )
| A. | Cl2 HBr HCl H2 | B. | Cl2 HCl HBr H2 | C. | H2HBr HCl Cl2 | D. | H2 HCl HBr Cl2 |
13.下列各组离子能在溶液中大量共存的是( )
| A. | Fe3+、K+、Br-、SCN- | B. | NH4+、Na+、CO32-、OH- | ||
| C. | K+、Na+、PO43-NO3- | D. | Al3+、Mg2+、SO42-HCO3- |
17.下列叙述中正确的是( )
| A. | 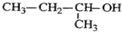 的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| B. | 软脂酸和油酸互为同系物 | |
| C. | 聚乙烯能使溴水褪色 | |
| D. | 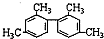 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 |
7.如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能.非常适合进行现场酒精检测.下列说法不正确的是( )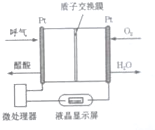

| A. | 电流由O2所在的铂电极流出 | |
| B. | O2所在的铂电极处发生还原反应 | |
| C. | 该电池的负极反应式为CH3CH2OH+3H2O-12e-=2CO2↑+12H+ | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量. |
11.物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是( )
| 物质及其杂质 | 检验 | 除杂 | |
| A | Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B | NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
| C | CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和NaHCO3溶液 |
| D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
| A. | A | B. | B | C. | C | D. | D |
12.化学与人们的日常生活密切相关,下列叙述正确的是( )
| A. | 二氧化硅是制造玻璃、光导纤维的原料 | |
| B. | 纤维素、油脂是天然有机高分子化合物 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | NOx、CO2、PM2.5颗粒都会导致酸雨 |
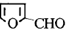 )与丙二酸合成香料过程中发生了
)与丙二酸合成香料过程中发生了
 (或
(或 、
、 ).
). CH3CH2OOCCH2COOCH2CH3+2H2O.
CH3CH2OOCCH2COOCH2CH3+2H2O. )与丙二酸可发生类似反应①的反应,写出有机产物的结构简式
)与丙二酸可发生类似反应①的反应,写出有机产物的结构简式 .
.