��Ŀ����
6�����б�ʾ��ȷ���ǣ�������| A�� | ������͵���-KI��ֽ��������е�KIO3��IO3-+5I-+6H+=3I2+3H2O | |
| B�� | CO��g����ȼ������283.0kJ/mol����2CO2��g��=2CO��g��+O2��g����H=-566.0KJ/mol | |
| C�� | Fe��OH��3��������Fe��OH��3+3H+=Fe3++3H2O | |
| D�� | ��ij������Һ�к��е����ʵ�����Cl-��I-��AlO2-��CO32-��NO3-��SiO32-�������֣����������������������ݣ���Һ��ɫ���ܣ�����Һ��һ����CO32- |
���� A�������������ɫ������Ԫ���غ㡢����غ��ж����ӷ���ʽ��
B��2CO2��g��=2CO��g��+O2��g��ΪCOȼ�շ�Ӧ���淴Ӧ�����2CO2��g��=2CO��g��+O2��g����H��0��
C��Fe3+�������Դ���I2�����Fe3+������I-��
D���������������������ɵⵥ�ʺ�NO�����������������������ݣ���Һ��ɫ�������Һ��һ����I-��NO3-��
��� �⣺A��IO3-+5I-+6H+=3I2+3H2O����Ԫ���غ㡢����غ㣬���ӷ���ʽ��ȷ�������������ɫ����������͵���-KI��ֽ��������е�KIO3����A��ȷ��
B����CO��g����ȼ������283.0KJ��mol-1����2CO��g��+O2��g��=2CO2��g����Ӧ�ġ�H=-2��283.0KJ��mol-1����2CO2��g��=2CO��g��+O2��g����Ӧ�ġ�H=+2��283.0KJ��mol-1����B����
C�� Fe��OH��3��������ᣬ����������ԭ��Ӧ�����ӷ���ʽΪ2I-+2Fe��OH��3+6H+�T2Fe2++6H2O+I2����C����
D��8H++2NO3-+6I-=3I2+2NO��+4H2O��CO32-+H+=CO2��+H2O�����������������������ݣ���Һ��ɫ�������Һ��һ����I-��NO3-�����ܺ���CO32-����D����
��ѡA��
���� �������ӷ���ʽ���Ȼ�ѧ����ʽ�������жϡ����Ӽ�������ӹ����֪ʶ���Ѷ��еȣ�ע�����������Ե�Ӧ�ã�

| A�� | 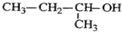 ��������2-��-1-���� ��������2-��-1-���� | |
| B�� | ��֬������ụΪͬϵ�� | |
| C�� | ����ϩ��ʹ��ˮ��ɫ | |
| D�� | 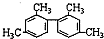 ������������11��̼ԭ�Ӵ���ͬһƽ�� ������������11��̼ԭ�Ӵ���ͬһƽ�� |
| A�� | 25��ʱ��pH=11��Na2CO3��Һ��ˮ���������H+��ĿΪ10-3NA | |
| B�� | 78gNa2S��Na2O2�Ļ�����������ӵ���ĿΪ2NA | |
| C�� | �ڱ�״���£�11.2LCCI4��������ԭ����ĿΪ2NA | |
| D�� | �����£�4.4g��ȩ�����������Ļ�����к���̼ԭ����ĿΪ0.2NA |
| ���ʼ������� | ���� | ���� | |
| A | Cl2��HCl�� | ʪ��ĵ���KI��ֽ | ����ʳ��ˮ |
| B | NO��NO2�� | �۲���ɫ��ʪ��ĵ���KI��ֽ | ˮ |
| C | CO2��HCl�� | AgNO3��Һ����ϡ���ᣩ | ����NaHCO3��Һ |
| D | NaHCO3��Һ��Na2CO3�� | Ca��OH��2��Һ | ����CO2 |
| A�� | A | B�� | B | C�� | C | D�� | D |
| ѡ�� | ʵ����� | ���ͻ���� |
| A | ��ij��Һ�еμ������ữ��BaCl2��Һ�����ְ�ɫ���� | ��Һ��һ������SO42- |
| B | ��ij����ͨ��Ʒ����Һ����Һ��ɫ��������ɫ�����Һ����Һ�ָֻ�ԭɫ | ������ΪSO2 |
| C | ������ˮ��ʪ��pH��ֽ����Һ��pH | һ����ʹ�ⶨ���ƫ�� |
| D | �����������Ҵ������������м�������������Һ | ����Һ�е�������Ҵ� |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� | ����̼�����ָ�����о���ʹ�ú�̼���ϵ͵����� | |
| B�� | ȼú�м���CaO��ɼ�������ķ���������������ŷ� | |
| C�� | ��ά���������ڿ�ˮ��Ϊ�����ǣ���������Ҫ��Ӫ������֮һ | |
| D�� | �����������ҵ硰�Ծɻ��¡����ɼ��ٻ�����Ⱦ����չѭ�����ã��ٽ����ܼ��� |
 ��
��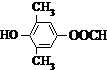 ��
��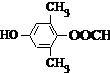 ��
��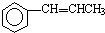 Ϊԭ���Ʊ�
Ϊԭ���Ʊ�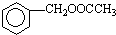 �ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�CH3CH2OH$��_{170��}^{Ũ����}$CH2=CH2$\stackrel{Br_{2}}{��}$CH2BrCH2Br��
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�CH3CH2OH$��_{170��}^{Ũ����}$CH2=CH2$\stackrel{Br_{2}}{��}$CH2BrCH2Br��