题目内容
19.己知Na2SO3溶液中存在水解平衡:SO32-+H2O?HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程.a试剂是酚酞,操作和现象是取样品溶于水,滴加酚酞显红色,加热后溶液红色加深.分析 亚硫酸根离子水解生成亚硫酸氢根离子和氢氧根离子,溶液显示碱性,可以选用酚酞作为指示剂,然后通入给亚硫酸钠溶液加热,根据溶液红色深浅判断温度对该平衡的影响.
解答 解:Na2SO3溶液中存在水解平衡:SO32-+H2O?HSO3-+OH-,所以Na2SO3溶液呈碱性,向溶液中滴加酚酞后,溶液变成红色,
加热后滴有酚酞的亚硫酸钠溶液的红色加深,证明亚硫酸钠的水解为吸热反应,加热后平衡SO32-+H2O?HSO3-+OH-向着正向移动,
故答案为:酚酞;取样品溶于水,滴加酚酞显红色,加热后溶液红色加深.
点评 本题考查了探究吸热反应和放热反应的方法,题目难度中等,根据平衡正确选用试剂为解答关键,注意掌握盐的水解原理及其影响因素,明确常见的化学实验基本操作方法,试题培养了学生灵活应用基础知识解决实际问题的能力.

练习册系列答案
相关题目
14.25℃时,下列有关溶液微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L CH3COONa与0.1 mol/L HCl溶液等体积混合:c(Na+)>c(Cl-)>cCH3COO-)>c(OH-) | |
| B. | 0.1mol/L NH4Cl与0.1mol/L 氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L Na2CO3与0.1mol/L NaHCO3溶液等体积混合:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| D. | 0.11 mol/L CH3COOH溶液与 0.1 mol/L NaOH溶液等体积混合,所的溶液中:c(OH-)>c(H+)+c(CH3COOH) |
7.下列有关同分异构体数目的叙述中,正确的是( )
| A. | C5H12有2种同分异构体 | |
| B. | C8H10中只有三种属于芳香烃的同分异构体 | |
| C. | CH3CH2CH2CH3光照下与氯气反应,只生成一种一氯代烃 | |
| D. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
14.满足相应条件的下列有机物,同分异构体数目最少的是( )
| 选项 | 分子式 | 结构或性质 |
| A | C5H10 | 能使溴的CCl4溶液褪色 |
| B | C7H7Br | 含甲基和苯环 |
| C | C5H12O | 能与Na反应生成H2 |
| D | C5H10O2 | 能与碳酸氢钠反应生成CO2 |
| A. | A | B. | B | C. | C | D. | D |
8.下列排序正确的是( )
| A. | 酸性:H2CO3<C6H5OH<CH3COOH | B. | 碱性:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 沸点:PH3<NH3<HF |
9.已知氮元素和氧元素组成的化合物中 氮元素和氧元素的质量比为7:16其化学式可能为( )
| A. | NO | B. | NO2 | C. | N2O | D. | N2O5 |
 转化为对甲基苯乙炔
转化为对甲基苯乙炔 的合成路线流程图如下:
的合成路线流程图如下:
 ,③的反应类型为加成反应.
,③的反应类型为加成反应.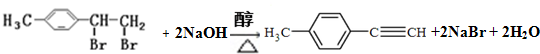 .
.