题目内容
13.短周期金属元素A~E在元素周期表中的相对位置如表所示,下面判断正确的是( )| A | B | |
| C | D | E |
| A. | 原子半径:C<D<E | |
| B. | 金属性:A>C | |
| C. | 氢氧化物的化学式及其碱性:COH>D(OH)2>E(OH)3 | |
| D. | 最外层电子数:A>B |
分析 由金属元素在短周期表中的位置可知,A为Li、B为Be、C为Na、D为Mg、E为Al.
A.同周期随原子序数增大,原子半径减小;
B.同主族自上而下,元素金属性增强;
C.同周期自左而右金属性减弱,金属性越强,最高价氧化物对应水化物的碱性越强;
D.同周期自左而右,最外层电子数增大.
解答 解:由金属元素在短周期表中的位置可知,A为Li、B为Be、C为Na、D为Mg、E为Al.
A.同周期随原子序数增大,原子半径减小,故原子半径C>D>E,故A错误;
B.同主族自上而下,元素金属性增强,故金属性A<C,故B错误;
C.C、D、E最高价氧化物对应水化物分别为其NaOH、Mg(OH)2、Al(OH)3,同周期自左而右金属性减弱,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Mg(OH)2>Al(OH)3,故C正确;
D.同周期自左而右,最外层电子数增大,故最外层电子数:A<B,故D错误,
故选C.
点评 本题考查元素周期表与元素周期律,注意对元素周期表的整体把握,熟练掌握同主族、同周期元素性质递变规律,侧重对基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.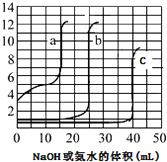 取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )
取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )
 取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )
取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )| A. | 由图可知曲线c为NaOH滴定硫酸 | |
| B. | 由图可知硫酸的物质的量浓度大于盐酸的物质的量浓度 | |
| C. | 曲线b、c的滴定实验可用酚酞做指示剂 | |
| D. | 由图可知滴定前醋酸电离度约为1.67% |
1.将锌片和铜片用导线连接置于稀硫酸溶液中,下列叙述错误的是( )
| A. | 锌片做负极,锌发生氧化反应 | B. | 铜片做正极 | ||
| C. | 溶液中的pH值增大 | D. | 溶液中的H+向负极移动 |
8.下列排序正确的是( )
| A. | 酸性:H2CO3<C6H5OH<CH3COOH | B. | 碱性:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 沸点:PH3<NH3<HF |
18.下列化学用语表述中正确的是( )
| A. | Cl-的结构示意图 | B. | MgCl2的电子式为 | ||
| C. | CCl4的结构式是 | D. | 高氯酸的分子式为HClO |
5.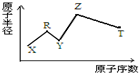 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 氢化物的沸点排序:Y>T>R | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |