题目内容
3.0.2 mol•L-1 NaHSO4和0.1 mol•L-1 BaCl2 溶液按等体积混合后,则溶液的pH等于1.分析 NaHSO4是强酸强碱酸式盐,属强电解质,溶液中完全电离,电离出Na+、H+、SO42-离子;,氯化钡是强电解质,电离时电离出自由移动的钡离子和氯离子,按等体积混合,反应本质为Ba2++SO42-=BaSO4↓,按等体积混合后,溶液中氢离子浓度变为原来的一半,根据pH=-lgc(H+)计算PH.
解答 解:硫酸氢钠属于二元强酸硫酸的酸式盐,能完全电离:NaHSO4=Na++H++SO42-,氯化钡是强电解质,电离时电离出自由移动的钡离子和氯离子,电离方程式为BaCl2=Ba2++2Cl-,0.2 mol•L-1 NaHSO4和0.1 mol•L-1 BaCl2 溶液按等体积混合,离子反应为Ba2++SO42-=BaSO4↓设混合前体积都为V,0.2 mol•L-1 NaHSO4溶液中氢离子的物质的量为:0.2mol•L-1×VL=0.2Vmol,氢离子未参加反应所以c(H+)=$\frac{0.2Vmol}{(V+V)L}$=0.1mol/L,混合后,溶液的pH=-lgc(H+)=1,
故答案为:1.
点评 本题考查了两种盐混合后的溶液的pH的计算,题目难度不大,注意掌握两种盐反应的本质以及pH的计算方法.

练习册系列答案
相关题目
13.下列叙述中能肯定说明金属A比金属B的活泼的是( )
| A. | A原子电子层数比B原子的电子层数多 | |
| B. | 常温时,A能从稀酸中置换出氢,而B不能 | |
| C. | A原子最外层电子数比B原子的最外层电子数少 | |
| D. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 |
14.25℃时,下列有关溶液微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L CH3COONa与0.1 mol/L HCl溶液等体积混合:c(Na+)>c(Cl-)>cCH3COO-)>c(OH-) | |
| B. | 0.1mol/L NH4Cl与0.1mol/L 氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L Na2CO3与0.1mol/L NaHCO3溶液等体积混合:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| D. | 0.11 mol/L CH3COOH溶液与 0.1 mol/L NaOH溶液等体积混合,所的溶液中:c(OH-)>c(H+)+c(CH3COOH) |
11.向0.15mol Cu粉与Fe粉的混合物中加入一定量的稀硫酸产生气体XL,然后加入一定量的稀硝酸,充分反应后固体全部溶解,收集到NO气体Y L,(气体体积均已换算到标准状况).则X+Y的数值可能是( )
| A. | 1.12 | B. | 2.24 | C. | 2.8 | D. | 4.48 |
18.已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
830℃时,向一个5L的密闭容器中充入0.2mol的A和0.8mol的B,下列说法不正确的是( )
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 该反应的△H<0 | |
| B. | 若反应经过一段时间后,达到平衡时A的转化率为80% | |
| C. | 如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1.则6s时 n(A)为0.11 mol | |
| D. | c(A)不随时间改变或单位时间里生成c和D的物质的量相等均可作为是否达到平衡的依据 |
3.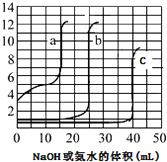 取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )
取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )
 取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )
取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )| A. | 由图可知曲线c为NaOH滴定硫酸 | |
| B. | 由图可知硫酸的物质的量浓度大于盐酸的物质的量浓度 | |
| C. | 曲线b、c的滴定实验可用酚酞做指示剂 | |
| D. | 由图可知滴定前醋酸电离度约为1.67% |
7.下列有关同分异构体数目的叙述中,正确的是( )
| A. | C5H12有2种同分异构体 | |
| B. | C8H10中只有三种属于芳香烃的同分异构体 | |
| C. | CH3CH2CH2CH3光照下与氯气反应,只生成一种一氯代烃 | |
| D. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
8.下列排序正确的是( )
| A. | 酸性:H2CO3<C6H5OH<CH3COOH | B. | 碱性:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 沸点:PH3<NH3<HF |
 转化为对甲基苯乙炔
转化为对甲基苯乙炔 的合成路线流程图如下:
的合成路线流程图如下:
 ,③的反应类型为加成反应.
,③的反应类型为加成反应.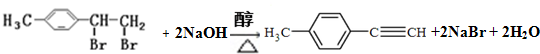 .
.