题目内容
3.在容积不变的密闭容器中进行如下反应:H2O(g)+C(s)?H2(g)+CO(g)△H>0 达到平衡后,只改变下列反应条件,相关叙述正确的是( )| A. | 加入H2O(g),平衡向正反应方向移动,体系压强减小 | |
| B. | 加入CO,混合气体的密度增大 | |
| C. | 降低温度,平衡向正反应方向移动 | |
| D. | 加入少量C,正反应速率增大 |
分析 A.加入H2O(g)即增加反应物的浓度,平衡向正反应方向移动,正反应又是气体体积增大的方向;
B.加入CO即增加生成物的浓度,虽然平衡向逆反应方向移动,但因为增加了CO,所以气体总质量仍然在变大;
C.降低温度,平衡向放热反应方向移动;
D.C为固体,增大碳的用量不影响反应速率.
解答 解:A.加入H2O(g)即增加反应物的浓度,平衡向正反应方向移动,正反应又是气体体积增大的方向,所以体系压强增大,故A错误;
B.加入CO即增加生成物的浓度,虽然平衡向逆反应方向移动,但因为增加了CO,所以气体总质量仍然在变大,体积不变,所以密度增大,故B正确;
C.降低温度,平衡向放热反应方向移动,即逆反应方向移动,故C错误;
D.C为固体,增大碳的用量不影响反应速率,故D错误;
故选B.
点评 本题考查化学平衡的影响因素,题目难度不大,本题注意观察方程式的特征,把握外界条件对平衡状态的影响.

练习册系列答案
相关题目
18.已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
830℃时,向一个5L的密闭容器中充入0.2mol的A和0.8mol的B,下列说法不正确的是( )
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 该反应的△H<0 | |
| B. | 若反应经过一段时间后,达到平衡时A的转化率为80% | |
| C. | 如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1.则6s时 n(A)为0.11 mol | |
| D. | c(A)不随时间改变或单位时间里生成c和D的物质的量相等均可作为是否达到平衡的依据 |
14.满足相应条件的下列有机物,同分异构体数目最少的是( )
| 选项 | 分子式 | 结构或性质 |
| A | C5H10 | 能使溴的CCl4溶液褪色 |
| B | C7H7Br | 含甲基和苯环 |
| C | C5H12O | 能与Na反应生成H2 |
| D | C5H10O2 | 能与碳酸氢钠反应生成CO2 |
| A. | A | B. | B | C. | C | D. | D |
18.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17.下列关于不溶物之间转化的说法中错误的是( )
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{8.5}{\sqrt{1.8}}$×10-12mol•L-1 |
8.下列排序正确的是( )
| A. | 酸性:H2CO3<C6H5OH<CH3COOH | B. | 碱性:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 沸点:PH3<NH3<HF |
12.某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA-?H++A2-,关于下列说法不正确的是( )
| A. | NaHA的水溶液可能呈酸性,也可能呈碱性 | |
| B. | 0.1mol•L-1Na2A溶液中,c(A2-)+c(HA-)=0.1 mol•L-1 | |
| C. | NaHA的水溶液中离子浓度关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | Na2A的水溶液中:c(Na+)=2c(HA-)+2c(A2-) |
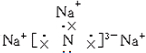 ;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.
;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.