题目内容
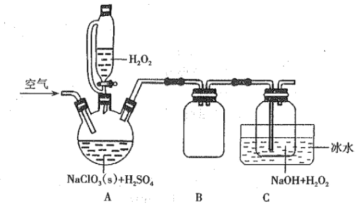
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
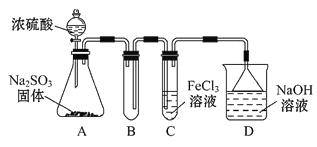
(1)通入足量SO2时C中观察到的现象为_____________________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42。该做法_______(填“合理”或“不合理”),理由是____________。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
【答案】溶液由棕黄色变成浅绿色 不合理 HNO3可以将SO2氧化成H2SO4,干扰实验 BC
【解析】
装置A中的分液漏斗中的浓硫酸滴入锥形瓶中反应生成二氧化硫气体,通过装置B为安全瓶,通过装置C中的氯化铁溶液具有氧化性能氧化二氧化硫为硫酸,氯化铁被还原为氯化亚铁,最后过量的二氧化硫被氢氧化钠溶液吸收,据此分析解答。
(1)利用Fe3+具有强氧化性,C中发生离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42+4H+,Fe3+显棕黄色,Fe2+显浅绿色,现象为溶液由棕黄色变成浅绿色;
(2)HNO3具有强氧化性,能把SO2氧化成H2SO4,干扰实验,因此该做法不合理;
(3)A、浓硫酸与SO2不发生反应,浓硫酸不能代替FeCl3,故A不符合题意;B、酸性高锰酸钾溶液具有强氧化性,如果紫红色褪去,说明SO2具有还原性,故B符合题意;C、碘水中I2,具有氧化性,能把SO2氧化,淡黄色褪去,说明SO2具有还原性,故C符合题意;D、NaCl溶液不与SO2发生反应,不能鉴别SO2有还原性,故D不符合题意。答案选BC。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分,请参照元素![]() 在表中的位置,用 化 学 用 语回答下列问题:
在表中的位置,用 化 学 用 语回答下列问题:
族 周期 | IA | 0 | ||||||
1 |
| ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 |
|
|
| |||||
3 |
|
|
|
| ||||
![]() 的原子结构示意图为_________。
的原子结构示意图为_________。
![]() 的气态氢化物分子的结构式为_____________。
的气态氢化物分子的结构式为_____________。
![]() 、
、![]() 的最高价含氧酸的酸性由强到弱的顺序是________________。
的最高价含氧酸的酸性由强到弱的顺序是________________。![]() 填化学式
填化学式![]()
![]() 、
、![]() 元素的金属性强弱依次为___________。
元素的金属性强弱依次为___________。![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]()
![]() 、
、![]() 、
、![]() 的形成的简单离子半径依次_______。
的形成的简单离子半径依次_______。![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]()
![]() 、
、![]() 元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。
元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。
【题目】某实验小组学习化学反应速率后,联想到H2O2分解制备氧气,设计如下实验方案探究外界条件对反应速率的影响。
编号 | 温度 | 反应物 | 催化剂 |
甲 | 25℃ | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
乙 | 25℃ | 试管中加入3mL5%H2O2溶液 | 1mL0.1mol/LFeCl3溶液 |
丙 | 40℃ | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
(1)实验乙中发生反应的化学方程式为_______________。
(2)实验甲和实验乙的实验目的是____________。实验甲和实验丙的实验目的是___________。
(3)实验过程中该同学对实验乙中产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验乙 | 15.0 | 29.5 | 43.5 | 56.5 | 69.5 | |
0~20s的反应速率v1=__________mL/s,100~120s的反应速率v2=__________mL/s。不考虑实验测量误差,二者速率存在差异的主要原因是__________。