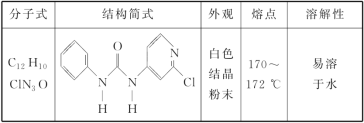
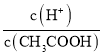题目内容
【题目】取一定量的CuCl2产品投入Na2CO3溶液中,充分反应后得到一种仅含四种元素的不溶性盐X,并产生气体CO2。设计如下实验探究X的组成和性质。已知各步反应所需试剂均过量,请回答:
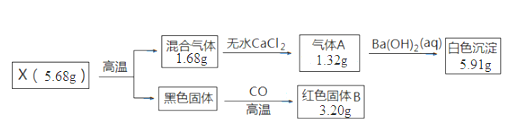
(1)混合气体的成分是__。
(2)X的化学式为__。
(3)写出CuCl2与Na2CO3反应生成X的离子方程式__。
【答案】H2O、CO2 Cu5(OH)4(CO3)3或2Cu(OH)23CuCO3 5Cu2++5![]() +2H2O== Cu5(OH)4(CO3)3+2CO2↑
+2H2O== Cu5(OH)4(CO3)3+2CO2↑
【解析】
X高温分解,生成的混合气体通过无水CaCl2后,质量减轻,则表明含有H2O(g),其质量为1.68g-1.32g=0.36g,n(H2O)=![]() =0.02mol;气体A为CO2,n(CO2)=
=0.02mol;气体A为CO2,n(CO2)=![]() =0.03mol,n(BaCO3)=
=0.03mol,n(BaCO3)=![]() =0.03mol。黑色固体高温条件下用CO还原,得到红色固体B应为Cu,物质的量为n(Cu)=
=0.03mol。黑色固体高温条件下用CO还原,得到红色固体B应为Cu,物质的量为n(Cu)=![]() =0.05mol,n(CuO)=n(Cu)=0.05mol。
=0.05mol,n(CuO)=n(Cu)=0.05mol。
(1)由以上分析知,混合气体中,n(H2O)=![]() =0.02mol,n(CO2)=
=0.02mol,n(CO2)=![]() =0.03mol,所以混合气体的成分是H2O、CO2。答案为:H2O、CO2;
=0.03mol,所以混合气体的成分是H2O、CO2。答案为:H2O、CO2;
(2)X的分解产物中,n(H2O)=0.02mol,n(CO2)=0.03mol,n(CuO)=0.05mol,则用氧化物表示的X为5CuO3CO22H2O,X的化学式为Cu5(OH)4(CO3)3或2Cu(OH)23CuCO3。答案为:Cu5(OH)4(CO3)3或2Cu(OH)23CuCO3;
(3)CuCl2与Na2CO3在水溶液中发生水解反应生成Cu5(OH)4(CO3)3和CO2,由此得出生成X的离子方程式5Cu2++5![]() +2H2O==Cu5(OH)4(CO3)3+2CO2↑。答案为:5Cu2++5
+2H2O==Cu5(OH)4(CO3)3+2CO2↑。答案为:5Cu2++5![]() +2H2O==Cu5(OH)4(CO3)3+2CO2↑。
+2H2O==Cu5(OH)4(CO3)3+2CO2↑。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案