题目内容
在一定温度下的定容容器中,当下列物理量不再发生变化时,不能表明可逆反应
A(g) + 2B(g) C(g) + D(g)(正反应为放热反应)已达到平衡状态的是
C(g) + D(g)(正反应为放热反应)已达到平衡状态的是
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.反应放出的热量 |
B
解析试题分析:A.由于该反应是反应前后气体体积不等反应,所以若混合气体的压强不变,则反应达到平衡,错误;B.因为反应是在体积固定的密闭容器中进行,反应前后气体的质量也不变,因此无论反应是否达到平衡,混合气体的密度都不会发生变化,因此混合气体的密度不变不能作为反应达到平衡的标志,错误;C.若反应未达到平衡,则B的物质的量就会发生变化,B的物质的量浓度也要变化,因此B的物质的量浓度不变可以作为判断平衡的标志,错误;D.若反应未达到平衡,则反应放出的热量就会发生变化,若能量不变,则反应达到平衡状态,反应放出的热量可以作为判断平衡的标志,错误。
考点:考查可逆反应平衡状态的判断的标志的知识。

某化学反应中,反应物B的物质的量浓度在20s内,从2.0mol/L变成了1.0mol/L,则这20s内B的反应速率为
A.0.05mol/(L s) s) | B.0.05 | C.0.5mol/(L s) s) | D.0.05mol/L |
一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取的措施是
| A.加入少量稀NaOH溶液 | B.加入少量CH3COONa固体 |
| C.加入少量NH4HSO4固体 | D.加入少量Na2CO3浓溶液 |
反应H2(g)+ I2(g) 
 2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内断裂n mol H-H键的同时形成2n mol H-I键 ②单位时间内生成n molI2的同时生成2n molHI ③2v正(H2)=v逆(HI) ④HI分子数不再改变 ⑤混合气体颜色不再改变 ⑥混合气体压强不再改变
| A.②④⑤⑥ | B.②③④⑤ | C.①③④⑤ | D.全部 |
下列过程中,需要增大化学反应速率的是( )
| A.钢铁腐蚀 | B.食物腐败 | C.塑料老化 | D.工业合成氨 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列说法正确的是 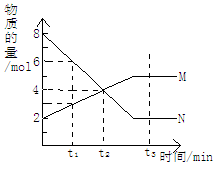
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
| A.反应容器内的压强不随时间改变 | B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 | D.反应容器内的气体总物质的量不随时间变化 |
 CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )
CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )