题目内容
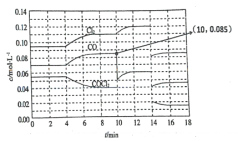
【题目】反应COCl2(g) ![]() Cl2(g) + CO(g) △H>0达到平衡时各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出)。
Cl2(g) + CO(g) △H>0达到平衡时各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出)。
下列说法正确的是
A. 第4 min时改变的条件可能是扩大容器体积
B. 第2 min时的平衡常数K(2)大于第8 min时的平衡常数K(8)
C. 12 min时反应在温度T(8)下重新达到平衡,则此时c(COCl2) = 0.031 mol/L(结果保留两位有效数字)
D. 产物CO在2~3 min、5~6 min、12~13 min时的平均反应速率大小为:υ(5~6) > υ(2~3) > υ(12~13)
【答案】C
【解析】
A. 4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,故A错误;B.第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动。4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,因为正反应为吸热反应,所以温度T(2)<T(8),则平衡常数K(2)<K(8),故B错误;C.由图可知,10min瞬间Cl2浓度不变,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故![]() =
=![]() =0.234mol/L,解得c(COCl2)=0.031mol/L,故C正确;D.根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0,在5~6min时,反应向正反应进行,故CO的平均反应速率为υ(5~6)>υ(2~3)= υ(12~13),故D 错误;故选C。
=0.234mol/L,解得c(COCl2)=0.031mol/L,故C正确;D.根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0,在5~6min时,反应向正反应进行,故CO的平均反应速率为υ(5~6)>υ(2~3)= υ(12~13),故D 错误;故选C。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________________________。
(2)②和③气态氢化物稳定性的大小顺序:___________(填化学式)。
(3)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________(填化学式),它属于________(填“共价化合物”或“离子化合物”)。
(5)①④⑩三种元素的原子能形成原子数目比为1∶1∶1的共价化合物,它的电子式为________。
(6)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是________(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性



